工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断ΔH 0 (填“>”、“=”或“<”);
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)= 0.2 mol/L,此时的温度为 。
(2)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇)。
(3)300℃、1.01×105Pa下,上述反应的ΔH数值为90.8 kJ/mol。在该温度下,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
|
| 反应物投入量 |
1 mol CO、2 mol H2 |
1 mol CH3OH |
2 mol CH3OH |
|
| 平衡时数据 |
CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应放出或吸收的能量 |
x kJ |
y kJ |
z kJ |
|
| 反应物转化率 |
Ф1 |
Ф2 |
Ф3 |
请比较以下每组数据的大小(填“>”、“<”或“=”):
①2c1 c3 ② x+y 90.8 ③Ф1+Ф3 1
在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。下列说法不正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。下列说法不正确的是
| A.该反应的正反应为放热反应 |
| B.压强大小关系为p1<p2<p3 |
| C.M点对应的平衡常数K的值约为1.04×10-2 |
| D.在p2及512 K时,图中N点v(正)<v(逆) |
右图表示可逆反应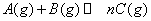
 ,在不同条件下反应混合物中C的质量分数C%和反应过程所需时间的关系曲线,有关叙述一定正确的是
,在不同条件下反应混合物中C的质量分数C%和反应过程所需时间的关系曲线,有关叙述一定正确的是
| A.a表示有催化剂,而b无催化剂 |
| B.若其他条件相同,a比b的温度高 |
| C.若其他条件相同,a比b的压强大,n=l |
| D.反应由逆反应方向开始 |
T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是
| A.平衡时X、Y的转化率相同 |
| B.达到平衡后,将容器体积扩大为4 L,平衡逆向移动 |
| C.平衡时X的正反应速率与Y的逆反应速率相等 |
D.T℃时,该反应的化学方程式为:X (g)+Y(g) 2Z(g),平衡常数K="40" 2Z(g),平衡常数K="40" |
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g) xC(g)△H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时问变化的关系如图2.
xC(g)△H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时问变化的关系如图2.
下列有关说法中正确的是
A.x=2,反应开始2 min内,v(A)=0.05mol•L﹣1•min﹣1
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大C的浓度,t2时正反应速率减小
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
在一密闭容器中,反应aA(气) bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增加了 | D.a>b |
氢气是一种清洁能源。制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。(1)用甲烷制取氢气的两步反应的能量变化如下图所示:
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
②第Ⅱ步反应为可逆反应。800℃时,若CO的起始浓度为2.0 mol·L-1,水蒸气的起始浓度为3.0 mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2 mol·L-1,则CO的平衡转化率为__________。
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B元素的化合价不变,该反应的化学方程式为 ,反应消耗1mol NaBH4时转移的电子数目为 。
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K= (用含a、b的关系式表达)。
(4)一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成)。
①实现有机物储氢的电极是 ;
| A.正极 | B.负极 | C.阴极 | D.阳极 |
其电极反应方程为: 。
②该储氢装置的电流效率η明显小于100%,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是 。由表中数据可知,此装置的电流效率η= 。[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位]。
反应aA(g)+bB(g) cC(g) ΔH<0。在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示。
cC(g) ΔH<0。在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示。
回答问题:
(1)反应的化学方程式中a∶b∶c为________;
(2)各阶段内,A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为 ;
(3)各阶段内,B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是_______,其值是________;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2________T3(填“>”、“<”、“=”)。
硫的化合物在科研、生活及化学工业中具有重要的应用。
(1)在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25℃,在0.10 mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
| pH |
3 |
5 |
7 |
9 |
11 |
| c(S2-)/ mol•L-1 |
1.4×10-15 |
1.4×10-11 |
6.8×10-8 |
1.3×10-5 |
1.3×10-3 |
某溶液含0.020 mol•L-1Mn2+、0.1 mol•L-1H2S,当溶液的pH=5时,Mn2+开始沉淀,则MnS的溶度积=________________。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g) 2H2(g)+S2(g) △H1,在膜反应器中分离出H2。
2H2(g)+S2(g) △H1,在膜反应器中分离出H2。
①已知:H2S(g) H2(g)+S(g) △H2,2S(g)
H2(g)+S(g) △H2,2S(g) S2(g)△H3。则△H1=_______(用含△H2、△H3的式子表示。
S2(g)△H3。则△H1=_______(用含△H2、△H3的式子表示。
②在密闭容器中,充入0.10molH2S(g),发生反应2H2S(g) 2H2(g)+S2(g),控制不同的温度和压强进行实验。结果如图所示。
2H2(g)+S2(g),控制不同的温度和压强进行实验。结果如图所示。
图中压强p1、p2、p3由大到小的顺序为_______________,理由是_________________。若容器的容积为2.0L,则压强为p3,温度为950℃时,反应经3h达到平衡,则达到平衡时v(S2)=__________;若压强p2=7.2MPa,温度为975℃时,该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),若保持压强不变,升温到1000℃时,则该反应的平衡常数___________(填“增大”“不变”或“减小”)。
(3)工业上用惰性电极电解KHSO4饱和溶液制取H2O2,示意图如图所示:
①低温电解饱和KHSO4溶液时阳极的电极反应式为_________________。
②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式为_________________。
(1)下列物质中,属于弱电解质的是(填序号,下同) ,属于非电解质的是 。
①亚硫酸溶液 ②次氯酸钠 ③氯化氢气体 ④蔗糖 ⑤硫酸钡
⑥氨气 ⑦冰醋酸 ⑧硫酸氢钠固体 ⑨氢氧化铁 ⑩NO2
(2)写出下列物质在水中的电离方程式
亚硫酸: ;次氯酸钠: ;
(3)甲、乙两瓶氨水的浓度分别为1mol·L-1、0.1mol·L-1,则c(OH-)甲:c(OH-)乙 10(填“大于”、“等于”或“小于”)。
(4)下表数据均在相同温度下测得,由此可知三种酸的酸性由强到弱的顺序为
| |
HX |
HY |
HZ |
| 浓度 mol·L-1 |
0.1 0.5 |
1.0 1.5 |
2.0 2.5 |
| 电离度 |
0.3% 0.13% |
0.3% 0.24% |
0.5% 0.45% |
(5)NO2与NO之间存在如下可逆反应:2NO2 2NO+O2。T℃时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是
2NO+O2。T℃时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是
①混合气体的颜色不再改变的状态
②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态
④混合气体的平均相对分子质量不再改变的状态
⑤ 的比值不再改变的状态
的比值不再改变的状态
可逆反应mA(g) nB(g)+pC(s); △H=Q, 温度、压强的变化对正、逆反应速率的影响符合图中的两个图像,以下叙述正确的是
nB(g)+pC(s); △H=Q, 温度、压强的变化对正、逆反应速率的影响符合图中的两个图像,以下叙述正确的是

| A.m>n, Q>0 | B.m>n,Q<0 | C.m>n+p,Q>0 | D.m<n+p, Q <0 |
FeCl3与KSCN混合时存在下列平衡:Fe3++SCN﹣⇌[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe( SCN)]2+与温度T的关系如图,则下列说法正确的是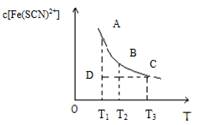
| A.FeCl3与KSCN反应的热化学反应方程式为:Fe3++SCN﹣⇌ [Fe( SCN)]2+△H>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1>K2 |
| C.反应处于D点时,一定有V正>V逆 |
| D.T2温度下,向B点溶液中加入FeCl3固体,平衡状态会从 B点变到A点 |
一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)  3C(g)+D(s),达到平衡时,C的浓度为ω mol/L。若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是
3C(g)+D(s),达到平衡时,C的浓度为ω mol/L。若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是
| A.4molA+2molB | B.3molC+2molD |
| C.1molB+3molC+1molD | D.2molA+1molB+3molC+1molD |
试题篮
()