(6分)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入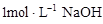 溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。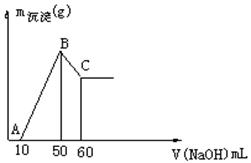
求:(1)合金中镁、铝各自的质量。
(2)盐酸的物质的量浓度。
设NA代表阿伏加德罗常数的值,下列说法不正确的是( )。
| A.阿伏加德罗常数NA是0.012kg12 C中所含的原子数 |
| B.2g氢气所含氢原子数目为NA |
| C.标况下,22.4L NH3所含的分子数目为NA |
| D.1 L 1 mo1·L-1 NaCl溶液中所含有的Na+离子数目为NA |
NA代表阿伏加德罗常数,以下说法正确的是( )
| A.9g水所含电子数为 5NA |
| B.常温常压下1 mol NO2气体与水在无氧条件下反应生成NA个NO3-离子 |
| C.标准状况下,11.2L三氧化硫溶于水,可生成0.5NA个硫酸分子 |
| D.62 g Na2O溶于水后所得溶液中含有Na+ 离子数为NA |
(本题共10分)
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:Na2SO4+ 4C Na2S+4CO↑ ② Na2SO4+4CO
Na2S+4CO↑ ② Na2SO4+4CO Na2S+4CO2
Na2S+4CO2
(1)现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
≤ n ≤ ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会被缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量盐酸,充分反应后过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各氧化产物的物质的量(不考虑气体在水中的溶解)。
(本题共6分)
某学生课外兴趣小组为了测定镁铝合金中铝的含量,进行了如下实验。将合金3.0克投入到足量的100 mL 1.5 mol•L-1的烧碱溶液中,充分反应后分离出未反应的镁,然后在溶液中滴加1.0 mol•L-1的盐酸,加入盐酸的体积与得到沉淀的数据如下表:
| 实验次数 |
加入盐酸的体积 |
沉淀质量 |
| 1 |
60 mL |
0 |
| 2 |
80 mL |
0.78 g |
| 3 |
180 mL |
5.46 g |
(1)开始沉淀时加入的盐酸体积必须大于 mL;若得到沉淀的量最大时,加入的盐酸体积为 mL。
(2)合金中铝的质量分数为 。
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,22.4L H2O 含有的分子数为NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C.通常状况下,NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
设NA表示阿佛加德罗常数的值,下列叙述中一定正确的是( )
| A.1molFeCl3制成胶体,所得胶体的粒子数为NA |
B.常温常压下乙烯和丁烯混合气a克,其中C—H键的数目为 |
| C.0.5mol/L 1升Al(NO3)3溶液中,Al3+的数目为0.5NA |
| D.标准状况下,22.4升庚烷中含碳原子数为7NA |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
①常温常压下,17g甲基(—14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标况时,22.4L二氯甲烷所含有的分子数为NA
⑥常温常压下,1mol氦气含有的核外电子数为4NA
| A.①② | B.③④ | C.②④ | D.⑤⑥ |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A.标准状况下,NA个SO3分子所占的体积约为22.4 L |
| B.在常温常压下,46 gNO2和N2O4混合物中所含原子的个数为3NA |
| C.1.8 g重水(D2O)中所含质子的个数为NA |
| D.7.8 g Na2O2固体中所含阴离子的总数为0.2 NA |
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A.1molCl2参加的任何反应,反应过程中转移电子数都是2NA |
| B.标准状况下,11.2L乙醇所含的羟基数为0.5NA |
| C.常温常压下,17g甲基(—14CH3)所含的中子数为9NA |
| D.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023个 |
用NA表示阿佛加德罗常数,下列说法正确的是( )
| A.22.4L O2的物质的量约为1mol |
| B.标准状况下,11.2L H2O的物质的量约为1 mol |
| C.1 L 1mol/L的NaOH溶液中Na+的物质的量为1 mol |
| D.5.6g铁与足量的盐酸完全反应,铁失去的电子数为0.1NA |
设NA表示阿伏加德罗常数的值,下列说法不正确的是 ( )
| A.1 mol醋酸的质量与NA个醋酸分子的质量相等 |
| B.NA个氧分子和NA个氮分子的质量比等于8:7 |
| C.28 g氮气所含的原子数目为NA |
| D.在标准状况下,0.5NA个氯气分子所占体积约是11.2 L |
若NA表示阿伏加德罗常数,下列说法正确的是( )
| A.pH=1的硫酸溶液所含的H+数为NA个 |
| B.20 g重水(D2O)中含有的电子数为10NA个 |
| C.粗铜电解精炼时,阳极减少6.4 g,则转移电子数一定是0.2 NA个 |
| D.在密闭容器中加入1molN2和3molH2充分反应可得到NH3分子数为2NA个 |
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是:
①________;②________;③________;④________。
(2)在稀释后的溶液中分别逐滴加0.1 mol/L的盐酸,产生的CO2的体积(标准状况)
与所加盐酸的体积关系如图所示: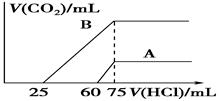
①分别加入足量的盐酸后的溶液中的溶质是________,原NaOH溶液的物质的量浓度为________。
②A曲线表明,原溶液通入CO2后,所得溶质与HCl反应产生CO2的最大体积是________mL(标准状况)。
③B曲线表明,原溶液通入CO2后,所得溶质的化学式为________,其物质的量之比为________。
试题篮
()