将2.0 mol/L CuSO4溶液和1.0 mol/L H2SO4溶液等体积混合。计算:
(1)混合液中CuSO4和H2SO4的物质的量浓度;
(2)混合液中Cu2+、 H+、SO42-的物质的量浓度。
(8分)从100ml某种待测浓度的Na2CO3溶液中取出50ml,加入含HCl0.4mol的盐酸溶液,恰好完全反应。
(1)生成CO2的物质的量是多少?
(2)待测Na2CO3溶液的物质的量浓度是多少?
(1)实验室常用的浓盐酸密度为1.17g/mL、质量分数为36.5%。此浓盐酸的物质的量浓度为 mol/L。取此浓盐酸43mL,用蒸馏水稀释至200mL,稀盐酸的物质的量浓度为 mol/L。
(2) 4.8g镁投入此200mL稀盐酸中,反应后,求:
①放出的H2在标准状况下的体积。
②将生成的H2通过过量的灼热CuO,求被还原出的铜的质量。
③反应后(设溶液体积不变)溶液中两种阳离子的物质的量浓度之比。
在室温下,向100mL Cu(IO3)2饱和溶液中加入足量的经硫酸酸化的KI溶液,发生如下反应: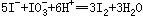 、
、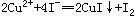 ,反应完全后,用0.1 mol/L的Na2S2O3溶液滴定,
,反应完全后,用0.1 mol/L的Na2S2O3溶液滴定, ,消耗了40 mL Na2S2O3溶液,计算:
,消耗了40 mL Na2S2O3溶液,计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度;
(2)若Cu(IO3)2饱和溶液的密度为1.0 g/cm3,室温时Cu(IO3)2的溶解度是多少?
将1.95gNa2SO4和Na2CO3的混合物溶于水得溶液A,在A中加入足量未知浓度的BaCl2溶液10.0mL,然后过滤得沉淀B;向B中加入足量稀盐酸,充分反应后剩余沉淀2.33g。计算:(1)原混合物中碳酸钠的质量分数;
(2)标况下,生成气体多少毫升;
(3)氯化钡溶液的物质的量的浓度。
有一稀硫酸和稀硝酸的混合溶液,取出其中的10mL,加入足量氯化钡溶液,将生成的沉淀滤出洗净,烘干称得质量为9.32g;另取这种溶液10mL与4mol/L的NaOH溶液25mL恰好完全中和;再取10mL原混合溶液与0.96g铜粉共热;
求:(1)稀硫酸的物质的量浓度是多少?
(2)有多少毫升气体产生?(标准状况下)
取3.5g长期存放的Na2SO3粉末(可能部分氧化为Na2SO4),加入过量的100mL某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为560mL,然后向溶液中渐渐加入0.5mol/L的Ba(OH)2溶液50mL,有沉淀生成,此时溶液呈中性。求①Na2SO3的纯度;②盐酸的物质的量浓度(写出反应的化学方程式)。
实验室里常用浓盐酸跟高锰酸钾反应来制取少量氯气,反 应的化学方程式为:2KMnO4 + 16HCl(浓)="=" 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
应的化学方程式为:2KMnO4 + 16HCl(浓)="=" 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
现用1L密度为1.19g/cm3、质量分数为36.5%的浓盐酸与一定质量的高锰酸钾反应,产生的氯气在标准状况下的体积为1.12L。
(1)计算反应中被氧化的HCl的物质的量。
(2)计算反应后溶液中H+的物质的量浓度。
有NaCl和KCl的混合物25g,溶于水形成溶液,加入1000g 7.14%的AgNO3溶液,充分反应后滤出沉淀,再向混合物加入100g Cu片,过一段时间取出(反应完全),洗涤干燥称其质量为101.52g,求原混合物中NaCl和KCl的物质的量各为多少?
硫酸和盐酸组成的混合液100 mL,与3.42g氢氧化钡粉末恰好完全反应后溶液呈中性。反应后经过滤、洗涤、干燥,得到沉淀2.33g。则分别计算原混合液中硫酸和盐酸的物质的量的浓度。(设溶液总体积始终不变)
(11分) 将标准状况下的11.2L氨气溶于100mL水中,得到密度为0.868 g·cm-3的氨水。(不考虑氨气与水的反应)
(1)该气体的物质的量= mol;溶液的体积= L;
所得氨水的物质的量浓度= mol·L-1。
(2)若取上述氨水30.0mL与70.0mL2.00mol·L-1的AlCl3溶液相混合,产生白色沉淀的质量是 g。
(3)若取某浓度的NaOH溶液50.0mL与50.0mL2.00mol·L-1的AlCl3溶液相混合,有白色沉淀产生,测得溶液中铝元素与沉淀中铝元素质量相等,则NaOH溶液的物质的量浓度为 mol·L-1
(共8分)常温下,在一刚性容器内部有一个不漏气且可以滑动的活塞,将容器分割成左右两室。左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的1/4(如图)。然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞正好停留在容器的中间。经检验,此时右室中气体可使带火星的木条复燃。
(1)求反应前H2和O2的物质的量之比。
(2)求反应前H2和O2混合气体的平均相对分子质量。
试题篮
()