某课外兴趣小组探究铝与盐酸反应的反应速率与哪些因素有关。请填写下列空白:
(1)实验化学反应原理: 。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
(3)实验装置(图中铁架台等夹持仪器略去)
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性
②取3块铝条(足量)加入到试管中。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。
②试判断OE、EF、FG段所收集气体的多少。
OE: ;EF: ;FG: 。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG 表示),并解释原因。
速率大小比较: 。原因:________
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气
的量,他在盐酸中分别加入下列溶液:
| A.蒸馏水 | B.NaCl溶液 | C.Na2CO3溶液 | D.CuSO4溶液 E. NaNO3溶液 |
你认为可行的是(填编号) 。
把下列四种X溶液分别加入四个盛有10mL 2mol/L的盐酸溶液的烧杯中(忽略体积变化),X和盐酸缓慢地进行反应,其中反应最快的是
| A.20mL 3mol/L 的X溶液 | B.30mL 2mol/L 的X溶液 |
| C.10mL 4mol/L 的X溶液 | D.20mL 2mol/L 的X溶液 |
下列关于化学反应速率的说法正确的是
| A.化学反应速率是指一定时间内任何一种反应物的物质的量的减少或任何一种生成物的物质的量的增加 |
| B.化学反应速率为0.8mol•L-1•s-1是指1秒钟时某物质的浓度为0.8mol•L-1 |
| C.根据化学反应速率的大小可以知道化学反应进行的快慢 |
| D.对于任何一个化学反应,反应速率越快,反应现象越明显 |
某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 |
铁的质量/g |
铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol·L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
| 1 |
0.10 |
片状 |
50 |
0.8 |
20 |
200 |
| 2 |
0.10 |
粉状 |
50 |
0.8 |
20 |
25 |
| 3 |
0.10 |
片状 |
50 |
1.0 |
20 |
125 |
| 4 |
0.10 |
片状 |
50 |
1.0 |
35 |
50 |
请分析上表信息,回答下列问题。
(1)实验1、2 表明 对反应速率有影响,其规律是 。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是 。
(忽略温度对反应速率的影响)
设C+CO2="2CO" △H>0的反应速率为V1;N2+3H2=2NH3△H<0的反应速率为V2。若升温,V1和V2的变化可能是:
| A.同时增大 | B.同时减少 |
| C.V1增大、V2减少 | D.V1减少、V2增大 |
可逆反应2SO2 + O2  2SO3,如果SO2的起始浓度为2 mol/L ,2min后SO2的浓度为1.8mol/L,则用SO2的浓度变化表示的反应速率为:
2SO3,如果SO2的起始浓度为2 mol/L ,2min后SO2的浓度为1.8mol/L,则用SO2的浓度变化表示的反应速率为:
| A.1mol/(L·min) | B.0.9mol/(L·min) |
| C.0.2mol/(L·min) | D.0.1mol/(L·min) |
下列反应:3A(气)+B(气)  2C(气)+2D(气)在不同条件下反应速率分别为:
2C(气)+2D(气)在不同条件下反应速率分别为:
①VA=0.6mol/(L·s) ②VB=0.45mol/(L·s)
③VC="0." 4mol/(L·s) ④VD=0.45mol/(L·s)
则此反应在不同条件下进行最快的是
| A.② | B.①③ | C.②④ | D.① |
下列措施是为了降低化学反应速率的是
| A.把石灰石固体研细后与盐酸反应 |
| B.食品放在冰箱中贮藏 |
| C.用MnO2作H2O2分解反应的催化剂 |
| D.铝和烧碱溶液反应时,稍微加热 |
下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧 剧烈______________
剧烈______________
(2) MnO2加入双氧水中反应更剧烈______________
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完___________
(4) 镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生________
铝与过量的稀盐酸反应,为了加快反应速率,同时几乎不影响生成的氢气总量,不可以采取的措施是
| A.加热,升高溶液温度 | B.加入适量的水 |
| C.加入少量CuSO4溶液 | D.加入浓度较大的盐酸 |
下列说法正确的是
| A.某一反应的活化分子百分数是个定值 |
| B.升高温度会加快化学反应速率,其原因是增加了活化分子百分数 |
| C.活化分子之间发生的碰撞一定为有效碰撞 |
| D.对有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子百分数,从而使反应速率增大 |
把0.8 mol X 气体和0.4 mol Y 气体混合于2 L密闭容器中,使它们发生如下反应:2 X(g)+ Y (g)  n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
n Z (g) +2 W (g)。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度。
(3)化学反应方程式中n 值是多少?
对于工业合成氨反应:N2+3H2 2NH3,下列说法错误的是
2NH3,下列说法错误的是
| A.使用合适的催化剂可以加快反应速率 |
| B.升高温度可以加快反应速率 |
| C.增大N2浓度可以使H2转化率达到100% |
| D.增大N2浓度可以加快反应速率 |
下列各组锌和盐酸的反应中,产生H2的反应速率最小的是
| 试管 |
盐酸浓度 |
温度 |
锌的状态 |
| A |
0.5 mol·L-1 |
20℃ |
块 状 |
| B |
0.5 mol·L-1 |
20℃ |
粉末状 |
| C |
2.0 mol·L-1 |
35℃ |
块 状 |
| D |
2.0 mol·L-1 |
35℃ |
粉末状 |
一定条件下,在体积固定的密闭容器中,一氧化碳与氢气生成甲醇的反应如下: 
CO(g) +2H2(g) 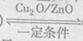 CH3OH (g)
CH3OH (g)
下列说法正确的是 ( )
| A.在其他条件不变的情况下,对处于E点的体系 体积压缩到原来的一半,氢气的浓度减少 |
| B.催化剂的存在使一氧化碳与氢气更大限度的 转化生成甲醇 |
| C.用CO表示的反应速率v(CO)D <v(CO)C |
D.反应达到平衡时,平衡常数表达式为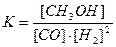 |
试题篮
()