一定条件下,可逆反应N2(g)+3H2(g)  2NH3(g) ΔH<0,化学反应速率与反应时间的关系如右图所示。10秒内,c(H2)下降了0.75mol/L,下列说法不正确的是:
2NH3(g) ΔH<0,化学反应速率与反应时间的关系如右图所示。10秒内,c(H2)下降了0.75mol/L,下列说法不正确的是:
| A.图中v1大于0.05 mol/(L·s) |
| B.氢气的起始瞬时速率为0.075mol/(L·s) |
| C.10秒内氨气的平均速率为0.05mol/(L·s) |
| D.其他条件不变,升高温度,v1增大,阴影面积减少 |
在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)  CH3OH(g);ΔH<0。第2 min时只改变一个条件,反应情况如下表:
CH3OH(g);ΔH<0。第2 min时只改变一个条件,反应情况如下表:
| 时间 |
c(CO)/ mol/L |
c(H2)/mol/L |
c(CH3OH)/ mol/L |
| 起始 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.2 |
| 第4 min |
0.4 |
1.8 |
0.6 |
| 第6 min |
0.4 |
1.8 |
0.6 |
下列说法不正确的是
| A.第4 min至第6 min该化学反应处于平衡状态 |
| B.第2 min时,如果只改变某一条件,则改变的条件可能是降低温度 |
| C.第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 |
| D.第6 min时,其他条件不变,如果升高温度,正反应速率增大 |
下图中P为一可自由滑动的活塞,K为容器A和B之间的旋塞。将K关闭,在A中充有1molX和1molY,B中充有3molX和3molY。起始时,V(A)=V(B)=1L,在相同的温度和有催化剂存在的条件下,两容器中各自发生反应:
X(g)+Y(g) 2Z(g)+W(g);△H<0。
2Z(g)+W(g);△H<0。
当达到平衡时,V (A)=1.25L。问:
(1)A中Y的转化率为 ,A、B中Y的转化率的关系是a(A) a(B)(填“<”、“>”或“=”)。
(2)如果将B端改装成与A端一致(如下图),
将K关闭,达到平衡后,B的体积为______L,
B中X的体积分数为___________________。
此时,如果将K打开,A中活塞_________(填“移动”或“不移动”,)
在一定的温度下,对于反应2A(g)+B(g)2C(g)在反应过程中C的物质的量n(C)随着时间变化关系如图所示,现从t1时间开始对反应体系升高温度,n(C)的变化如图所示。试回答下列问题:
(1)p点时反应的v正 v逆(选填“>”、“<”或“=”)。
(2)此反应的正反应为 热反应(填“放”或“吸”)。
(3)a、b两点的正反应速率:va vb(“>”、“<”或“=”)。
在某一容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g);ΔH=a kJ/mol(a>0)
反应达到平衡后,测得c(CO)∶c(CO2)=3∶2。下列说法正确的是( )
| A.反应放出的热量为0.2a kJ |
| B.平衡时H2O的转化率为40% |
| C.若升高温度,v(正)加快,v(逆)减慢,平衡正向移动 |
| D.若将容器的体积压缩为1L,有利于该反应平衡正向移动 |
右图为条件一定时,反应2NO+O2  2NO2+Q(Q>0)中NO的最大转化率与温度变化关系曲线图,图中有A、B、C、D、E五点,其中表示未达到平衡状态,且V正<V逆的点是
2NO2+Q(Q>0)中NO的最大转化率与温度变化关系曲线图,图中有A、B、C、D、E五点,其中表示未达到平衡状态,且V正<V逆的点是
A.B和C B.A和E
C.E D.A和C
对可逆反应:2A(g) + B(s)  3C(s) + 2D(g);ΔH﹤0 下图所示为正逆反应速率(v)与时间(t)关系的示意图,
3C(s) + 2D(g);ΔH﹤0 下图所示为正逆反应速率(v)与时间(t)关系的示意图, 如果在t1时刻改变以下条件:①升温; ②加入催化剂;
如果在t1时刻改变以下条件:①升温; ②加入催化剂; ③加入A;④加压;⑤减少C,
③加入A;④加压;⑤减少C,
符合图示的条件是 ( )
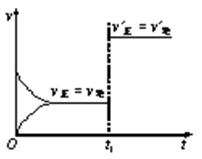
| A.②④ | B.①② |
| C.③④ | D.④⑤ |
已知0.1的醋酸溶液中存在电离平衡:

要使溶液中
值增大,可以采取的措施是
| A. | 加少量烧碱溶液 | B. | 升高温度 | C. | 加少量冰醋酸 | D. | 加水 |
一定条件下,在体积为3的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为
):


根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式=,升高温度,
值(填"增大"、"减小"或"不变")。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时增大
(4)据研究,反应过程中起催化作用的为,反应体系中含少量
有利于维持催化剂
的量不变,原因是:(用化学方程式表示)。
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应 A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率时间变化的如下图所示。下列说法正确的是
A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率时间变化的如下图所示。下列说法正确的是
| A.8min前A的平均反应速率为0.08 mol ·L-1·min-1 |
| B.20min~40min间该反应的平衡常数为5 |
| C.30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D.反应方程式中的x=1,且正反应为放热反应 |
化合物在一定波长的光照射下发生分解反应,反应物浓度

随反应时间变化如右图所示,计算反应4~8间的平均反应速率和推测反应16
时反应物的浓度,结果应是
| A. |
2.5 |
| B. |
2.5 |
| C. |
3.0 |
| D. |
5.0 |
(15分)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g) 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1
请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92kJ(填“大于”、“等于”或“小于”) ,原因是
,原因是
;若加入催化剂,ΔH (填“变大”、“变小”或“不变”)。
(2)下列有关合成氨反应速率的叙述,不正确的是 (选填序号)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
e.温度升高,其平衡常数数值变小
(3)已知:分别破坏1mol N N键、1mol H
N键、1mol H H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N H键需要吸收的能量为 kJ。
H键需要吸收的能量为 kJ。
(4)N2H4可视为:NH3分子中的H被-NH2取代的产物。
发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g)  ΔH1=+67.7 kJ/mol
ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
则:1mol N2H4完全反应的热化学方程式为 。
在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
| 序号 |
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶解于酸的时间/s |
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
30 |
t1 |
| E |
2 |
薄片 |
35 |
50 |
| F |
2 |
颗粒 |
15 |
t2 |
| G |
2 |
粉末 |
15 |
t3 |
则下列说法正确的是( )
①t1="75" s②t2高于200高于t3③单位时间内消耗的锌的质量m(G)>m(F)>m(B)
A.① B.①② C.② D.全部正确
试题篮
()