在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g) ⇌2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法不正确的是
| A.该温度下此反应的平衡常数K=1.44 |
| B.其他条件不变,升高温度,反应达到新平衡前V(逆)< V (正) |
| C.反应前2 min的平均速率v (Z)=4.0×10-3mol/(L·min) |
| D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是
CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是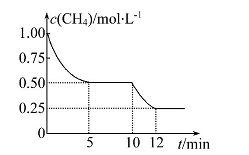
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v(逆)>v(正) |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。

下列分析不正确的是:
A.0~4分钟时,A的平均反应速率为0.02mol/(L•min)
B.该反应的平衡常数表达式K=
C.由T1向T2变化时,正反应速率大于逆反应速率
D.此反应的正反应为放热反应
下列有关化学反应原理的应用叙述中,正确的是
| A.用明矾净水是因为Al3+水解生成的Al(OH)3胶粒具有很强的吸附性 |
| B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| C.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 |
| D.工业合成氨使用催化剂是为了加快反应速率和提高氨的产量 |
高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)  Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为: K = c(CO2)/c(CO),已知1100 ℃时K =0.263。
Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为: K = c(CO2)/c(CO),已知1100 ℃时K =0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值______;平衡常数K值______(选填“增大”“减小”或“不变”)。
(2)1100 ℃时测得高炉中c(CO2)="0.025" mol/L、c(CO)="0.1" mol/L,在这 种情况下,该反应是否处于化学平衡状态______(选填“是”或“否”),此时,化学反应速率是v正______v逆(选填“大于”“小于”或“等于”);
(3) 目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=—49.0 kJ·mol-1。现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=—49.0 kJ·mol-1。现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②若改变条件使平衡向正反应方向移动,则平衡常数______________(填序号)
| A.可能不变 | B.可能减小 | C.可能增大 | D.不变、减小、增大皆有可能 |
恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
| 反应时间/min |
n(MgSO4)/mol |
n(CO)/mol |
n(CO2)/ mol |
| 0 |
2.00 |
2.00 |
0 |
| 2 |
|
0.80 |
|
| 4 |
|
|
1.20 |
下列说法正确的是
A.反应在0~2min内的平均速率为v(SO2)=0.6 mol·L-1·min-1
B.反应在2~4min内容器内气体的密度没有变化
C.若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D.保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol
T℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
| A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min) |
| B.平衡时容器内的压强为反应前的0.9倍 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是
| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)  2NH3(g) ΔH<0,反应过程如图:下列说法正确的是
2NH3(g) ΔH<0,反应过程如图:下列说法正确的是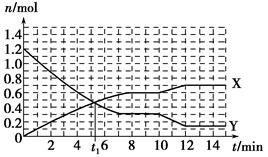
| A.t1 min时正、逆反应速率相等。 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
C.0~8 min,H2的平均反应速率v(H2)= mol·L-1·min-1 mol·L-1·min-1 |
| D.10~12 min,升高温度使反应速率加快,平衡正向移动 |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应 X(g)+Y(g)  2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
为探究外界条件对反应:mA(g)+nB(g) cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是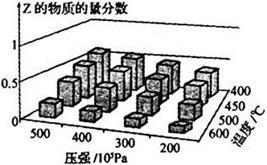
| A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大 |
| B.升高温度,正、逆反应速率都增大,平衡常数增大 |
| C.△H>0 m+n>c |
| D.温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小 |
炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2 L的密闭容器中,高温下进行下列反应:C(s)+CO2(g) =2CO(g) ΔH=Q kJ·mol-1。下图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
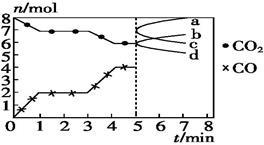
| A.0~1 min,v(CO)=1 mol·L-1·min-1;1~3 min,v(CO)=v(CO2) |
| B.当容器内的压强不变时,反应一定达到平衡状态,P(平衡) /P(起始) < 1 |
| C.3 min时,温度由T1升高到T2,则Q>0,再达平衡时,K(T2)/ K(T1)> 1 |
| D.5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化 |
下列说法中正确的是( )
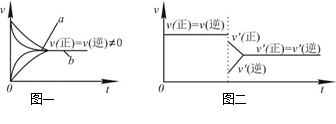
| A.Na2S2O3+2HCl==2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 |
B.若在恒容容器中发生反应:N2+3H2 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 |
| C.在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率—时间图像可用图一表示 |
D.若在恒压容器中发生反应:2SO3 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 |
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3﹣+HSO3﹣→SO42﹣+Cl﹣+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3﹣在单位时间内物质的量浓度变化表示的该反应V﹣t图.下列说法中不正确的是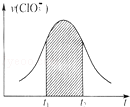
| A.反应开始时速率增大可能是c(H+)所致 |
| B.纵坐标为V(H+)的V﹣t曲线与图中曲线完全重合 |
| C.后期反应速率下降的主要原因是反应物浓度减小 |
| D.图中阴影部分“面积”可以表示t1﹣t2时间为c(Cl﹣)增加 |
在t℃时,10L 0.4mol·L-1H2O2溶液发生催化分解:2H2O2 = 2H2O + O2↑,不同时刻测得生成O2的体积如下表,已知反应至6min时,H2O2分解了50%(已折算为标准状况)
| t /min |
0 |
2 |
4 |
6 |
| V(O2)/L |
0.0 |
9.9 |
17.2 |
V=? |
下列叙述正确的是(溶液体积变化忽略不计)
A.0~2min H2O2平均反应速率比4~6min慢
B.反应至6min时,共产生O2 44.8L
C.0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol·L-1·min-1
D.反应至6min时,c(H2O2) = 0.3mol·L-1
试题篮
()