在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是
| A.前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1 |
| B.在2 s时,体系内压强为反应前的1.1倍 |
| C.平衡时,体系内含N2O4 0.25 mol |
| D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率 |
已知图①~④的相关信息,下列相应叙述正确的是 ( )
A.图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)  3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率 3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率 |
B.图②表示压强对可逆反应A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强小 3C(g)+D(s)的影响,乙的压强比甲的压强小 |
| C.据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右 |
| D.常温下,稀释0.1mol/LNa2CO3溶液,图④中的纵坐标可表示溶液中HCO3-的数目 |
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A(g)+B(g)  2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
①用物质A表示反应的平均速率为0.3 mol/(L·s)
②用物质B表示反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。已知:K(300℃)>K(350 ℃),则该反应正反应是 热反应。
(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v(O2)= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
以下是对化学反应变化过程及结果的研究。按要求回答问题:
Ⅰ.关于反应速率和限度的研究
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
则等物质的量浓度的①CH3COONa、②NaCN、③Na2CO3、④NaHCO3溶液的pH由大到小的顺序为__________(填编号)。
(2)已知2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1,在一个容积为2 L的容器中加入2 mol SO2和1 mol O2,在某温度下充分反应,经过30 min达到平衡,放出热量176.94 kJ。如果用SO2表示该反应的反应速率,则v(SO2)=________。
(3)下图为某温度下,CuS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是________。
向新生成的ZnS浊液中滴入足量含相同浓度的Cu2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为________(填化学式)沉淀。
Ⅱ.关于电化学的研究
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:VO2++2H++V2+ V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
V3++VO2++H2O。则充电时阳极反应式为__________________________,用此电池电解1 L 1 mol·L-1的CuSO4溶液,当转移0.1 mol电子时,溶液的pH=________(不考虑溶液体积变化)。
在一定条件下,对于密闭容器中的反应:N2 + 3H2 2NH3,下列说法正确的是
2NH3,下列说法正确的是
| A.增加N2的量,可以加快反应速率 |
| B.当N2和H2全部转化为NH3时,反应才达到最大限度 |
| C.达到平衡时,H2和NH3的浓度比一定为3∶2 |
| D.分别用N2和NH3来表示该反应的速率时,数值大小相同 |
某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
| A.0~12 min,初始浓度越大的实验,水解反应速率越大 |
| B.c(NH2COO-)将随反应时间的不断延长而一直减小至0 |
| C.25 ℃时0~6 min,v(NH2COO-)为0. 05 mol·L-1·min-1 |
| D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1 |
一定条件下存在反应:C(s)+H2O(g)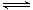 CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 |
甲 |
乙 |
 丙 丙 |
| 容积 |
0.5 L |
0.5 L |
V |
| 温度 |
T1 ℃ |
T2 ℃ |
T1 ℃ |
| 起始量 |
2 molC1 molH2O |
1 molCO 1 molH2 |
4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V < 0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1 < T2
反应A+3B=2C+2D在不同条件下反应速率如下,其中最快的是
| A.VA=0.15mol/(L·min) | B.VB=0.6mol/(L·min) |
| C.VC=0.4mol/(L·min) | D.VD="0.0075" mol/(L·s) |
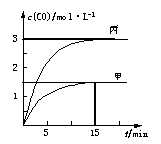
为探究外界条件对反应:mA(g)+nB(g) cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是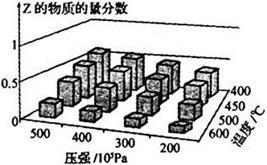
| A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大 |
| B.升高温度,正、逆反应速率都增大,平衡常数增大 |
| C.△H>0 m+n>c |
| D.温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小 |
炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2 L的密闭容器中,高温下进行下列反应:C(s)+CO2(g) =2CO(g) ΔH=Q kJ·mol-1。下图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
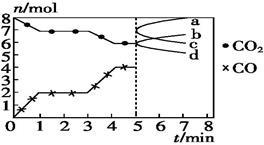
| A.0~1 min,v(CO)=1 mol·L-1·min-1;1~3 min,v(CO)=v(CO2) |
| B.当容器内的压强不变时,反应一定达到平衡状态,P(平衡) /P(起始) < 1 |
| C.3 min时,温度由T1升高到T2,则Q>0,再达平衡时,K(T2)/ K(T1)> 1 |
| D.5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化 |
下列说法中正确的是( )
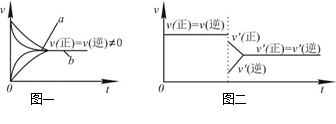
| A.Na2S2O3+2HCl==2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 |
B.若在恒容容器中发生反应:N2+3H2 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 |
| C.在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率—时间图像可用图一表示 |
D.若在恒压容器中发生反应:2SO3 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 |
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3﹣+HSO3﹣→SO42﹣+Cl﹣+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3﹣在单位时间内物质的量浓度变化表示的该反应V﹣t图.下列说法中不正确的是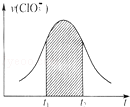
| A.反应开始时速率增大可能是c(H+)所致 |
| B.纵坐标为V(H+)的V﹣t曲线与图中曲线完全重合 |
| C.后期反应速率下降的主要原因是反应物浓度减小 |
| D.图中阴影部分“面积”可以表示t1﹣t2时间为c(Cl﹣)增加 |
在t℃时,10L 0.4mol·L-1H2O2溶液发生催化分解:2H2O2 = 2H2O + O2↑,不同时刻测得生成O2的体积如下表,已知反应至6min时,H2O2分解了50%(已折算为标准状况)
| t /min |
0 |
2 |
4 |
6 |
| V(O2)/L |
0.0 |
9.9 |
17.2 |
V=? |
下列叙述正确的是(溶液体积变化忽略不计)
A.0~2min H2O2平均反应速率比4~6min慢
B.反应至6min时,共产生O2 44.8L
C.0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol·L-1·min-1
D.反应至6min时,c(H2O2) = 0.3mol·L-1
试题篮
()