(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L-1·min-1,则以物质B表示此反应的化学反应速率为________mol·L-1·min-1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为________________。
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有________mol A,此时C的物质的量浓度为______。
已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g) CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
CO2(g)+H2(g) ,800℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
(1)求4 min内H2的平均化学反应速率。
(2)计算800℃时该反应的平衡常数。
(3)427℃时该反应的化学平衡常数为9.4,请结合(2)中的计算结果判断该反应的ΔH 0(填“>”、“<”或“=” )。
在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2 2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:
2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:
(1)NO2的转化率为多少?
(2)反应前后的压强比为多少?
(3)计算该温度下反应的平衡常数.
(4)在这5分钟内,用O2来表示的平均反应速率是多少?
某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)  2NH3(g) 在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)
2NH3(g) 在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)
(1)该温度下,反应的平衡常数是多少?
(2)H2的起始浓度;
(3)用N2表示该反应的反应速率是多少;
(4)N2的转化率(保留三位有效数字);
将等物质的量A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) =-49.0kJ·mol
=-49.0kJ·mol
某科学实验小组将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
(1)该反应在0~8min内CO2的平均反应速率是 mol·L-1·min-1
(2)此温度下该反应的平衡常数K的数值为 。
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。
与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是 。若实线对应条件下平衡常数为 ,曲线Ⅰ对应条件下平衡常数为
,曲线Ⅰ对应条件下平衡常数为 ,曲线Ⅱ对应条件下平衡常数为
,曲线Ⅱ对应条件下平衡常数为 ,则
,则 、
、 和
和 的大小关系是 。
的大小关系是 。
(1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v(CO2)表示的平均反应速率为 (第二位小数)。
②该反应为 (填“吸热”或“放热”)反应。
③求实验2的平常常数K,要求写出计算过程,结果取二位小数。
(2)已知在常温常压下:

写出甲醇不完全燃烧生成CO和液态水的热化学方程式 。
(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2。则负极的电极反应为 。

(4)CaCO3的KSP=2.8×10¯9。将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10¯4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为 。
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
①恒温恒容条件下,不能说明该反应已达到平衡状态的是________(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
②能使该反应的反应速率增大,且平衡向逆反应方向移动的是________(填序号);
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
③对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填序号);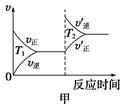
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0;820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=1.0。
CO2(g)+H2(g) ΔH<0;820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=1.0。
| 起始物质的量 |
甲 |
乙 |
丙 |
| n(H2O)/mol |
0.10 |
0.20 |
0.20 |
| n(CO)/mol |
0.10 |
0.10 |
0.20 |
①该反应的平衡常数表达式为___________;平衡时,甲容器中CO的转化率= ;
②平衡时,比较下列容器中CO的转化率:乙 甲(填“>”、“=”或“<”,下同);丙 甲。
将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,c(A)︰c(B)=3:5,C的平均反应速率是0.1m0L/(L·min)
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,c(A)︰c(B)=3:5,C的平均反应速率是0.1m0L/(L·min)
求:(1)反应开始前放入容器中A、B物质的量。(2)B的平均反应速率。(3)x值是多少?
在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
(1)x值
(2)B的平衡浓度
(3)A的转化率
(4)用A表示的化学反应速率
在1.0密闭容器中放入0.10molA(g)
,在一定温度进行如下反应应:

反应时间()与容器内气体总压强(
)的数据见下表:
| 时间 |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强 |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高的平衡转化率,应采取的措施为。
(2)由总压强和起始压强
计算反应物
的转化率
的表达式为。
平衡时的转化率为,列式并计算反应的平衡常数
。
(3)①由总压强和起始压强
表示反应体系的总物质的量
总和反应物
的物质的量
,
总=
,
=
。
②下表为反应物浓度与反应时间的数据,计算
=
| 反应时间 |
0 |
4 |
8 |
16 |
| 0.10 |
a |
0.026 |
0.0065 |
分析该反应中反应反应物的浓度变化与时间间隔(
)的规律,得出的结论是,
由此规律推出反应在12时反应物的浓度
为
。
)将等物质的量的A、B混合于2L密闭容器中发生如下反应:
3A(g)+B(g)=xC(g)+2D(g) 经5分钟后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min) 求:
(1)此时A的浓度及反应开始前容器中A、B的物质的量分别为 、 、
(2)B的平均反应速率
(3)x=
在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+ O2 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
(1)2min内,平均反应速率v(SO3)=
(2)2min时,SO2的浓度为
把0.2molX气体和0.5molY气体混合于1L密闭容器中,使它们发生如下反应:2X(g)+3Y(g)=nZ(g)+4W(g)。2min末已生成0.2molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L•min),试计算:
(1)前2min内用W的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
试题篮
()