某化学反应2A(g)  B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为____________mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。
在一密闭容器中充入1 mol H2和1 mol I2(g),压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)="==2HI(g)" ΔH<0。
(1)保持容器容积不变,向其中加入1 mol H2,反应速率________(填加快、不变或者减慢,下同),理由是_________________________。
(2)保持容器容积不变,向其中加入1 molHe,反应速率________,理由是__________________。
(3)保持容器内气体压强不变,向其中加入1 mol He,反应速率________,理由是__________。
(4)保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率________,理由是________________________________。
(5)提高起始的反应温度,反应速率________,理由是________________________。
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/S |
X/mol |
Y/mol |
Z/mol |
 |
| 0 |
1.00 |
1.00 |
0.00 |
|
| 1 |
0.90 |
0.80 |
0.20 |
|
| 3 |
0.75 |
0.50 |
0.50 |
|
| 5 |
0.65 |
0.30 |
0.70 |
|
| 9 |
0.55 |
0.10 |
0.90 |
|
| 10 |
0.55 |
0.10 |
0.90 |
|
| 14 |
0.55 |
0.10 |
0.90 |
(2)体系中发生反应的化学方程式是______________;
(3)列式计算该反应在0-3S时间内产物Z的平均反应速率:_______________;
(4)该反应达到平衡时反应物X的转化率等于___________________________;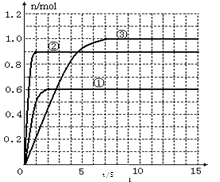
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:①_________②________③________。
在一密闭容器中发生反应N2+3H2 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:

(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 3A(g)+B(g) xC(g)+2D(g),经过5min后测得D的浓度为0.5 mol/L,c(A)∶c(B)=3:5,C的反应速率是0.1mol/(L·min)。
xC(g)+2D(g),经过5min后测得D的浓度为0.5 mol/L,c(A)∶c(B)=3:5,C的反应速率是0.1mol/(L·min)。
(1)x的值是 ;
(2)A在5min末的浓度是___________;
(3)B的平均反应速率是______ __,A的转化率是_______________。
在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 , (答两种);
(3)为了进一步研究上述反应中硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下6组实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实 验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1H2SO4 / mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液 / mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O / mL |
V7 |
V8 |
V9 |
15 |
10 |
0 |
请完成此实验设计,其中:其中:V2 V5(填“>”、“<”或“=”);
V5= , V6= ,V8= ;(填具体数值)
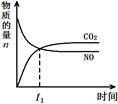
在2 L的密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=____________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v= 。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:CO2(g) + 3H2(g) ⇌CH3OH(g) + H2O(g) △H =﹣49.0 kJ/mol。相关数据如下:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1 mol CO2(g)和3 mol H2(g) |
1 mol CH3OH(g)和1 mol H2O(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出29.4 kJ |
吸收a kJ |
请回答:
①c1 c2(填“>”、“<”或“=”);a = 。
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是 mol/(L·s)。
(2)压强为p1时,向体积为1 L的密闭容器中充入b mol CO和2b mol H2,发生反应CO(g)+2H2(g) ⇌CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图所示。请回答:
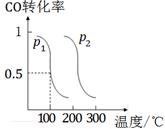
①该反应属于 (填“吸”或“放”)热反应;
p1 p2(填“>”、“<”或“=”)。
②100℃时,该反应的平衡常数K= (用含b的代数式表示)。
(3)治理汽车尾气的反应是2NO(g)+2CO(g)⇌2CO2(g)+N2(g) △H<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是 (选填字母)。
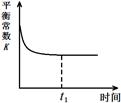
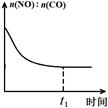
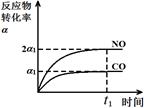
a b c d
(一) A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/l。反应进行2min后A的浓度为0.8mol/l, B的浓度为0.6mol/l, C的浓度为0.6mol/l。则2min内反应的平均速率为v(A)= ,v (B) = ,v(C)= 。该反应的化学反应方程式为: 。
(二) 比较下列各组热化学方程式中的ΔH的大小关系。
(1)已知1 mol白磷转化成红磷,放出18.39 kJ的热量,又知:①P4 (白,s)+5O2(g)=2P2O5(s) ΔH1,
②4P(红,s)+5O2(g)=2P2O5(s) ΔH2。
则ΔH1和ΔH2的关系:ΔH1 ΔH2
(2)③ S(g)+O2(g)==SO2(g) △H1
④S(s)+O2(g)==SO2(g) △H2 ΔH1 ΔH2
(3)已知:高温下,在密闭容器中用H2还原WO2可得到金属钨。当温度过高时,WO2(s)会转变为WO2 (g)。请根据以下反应:
⑤WO2 (s) + 2H2 (g) 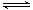 W (s) + 2H2O (g) ΔH = +66.0 kJ· mol-1
W (s) + 2H2O (g) ΔH = +66.0 kJ· mol-1
⑥WO2 (g) + 2H2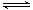 W (s) + 2H2O (g) ΔH = -137.9 kJ· mol-1
W (s) + 2H2O (g) ΔH = -137.9 kJ· mol-1
计算出WO2 (s) 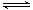 WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
氮可形成多种氧化物,如NO、NO2、N2O4等。
(1)电解NO制备NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____,理由是:_____________________________。

(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2‾)和c(CH3COO‾)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4 mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400 mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g) N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
| 时间/s |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0. 08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol/(L.min);n3 n4(填“>”、“<”或“=”),该反应的平衡常数的值为 。
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是 mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为 。
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O (g) =CO(g) + 3H2(g) △H =+206.0 kJ/mol
II:CO (g) + 2H2 (g) = CH3OH (g) △H =—129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图

假设100 ℃时达到平衡所需的时间为15min,则用H2表示该反应的平均反应速率为_______________。
(3)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式:______________。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

① 写出阳极电极反应式_______________。
② 写出除去甲醇的离子方程式_________________。
有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
2C(g),△H<0。
(1)若将4 mol A和2 mol B在2 L的容器中混合,经2 s后测得C的浓度为0.6 mol/L,用物质A表示的平均反应速率为_____;2s时物质B的浓度为__________;
(2)若将4 mol A和2 mol B加入体积不变的容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2 mol。此时,混合气体中C的体积分数为__________;若再通入少量B气体,体系中A的物质的量_________(填“增大”、“减小”或“不变”),若要使A的物质的量再达到与原平衡状态相同,可采取的三种措施有 、 、
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列措施中既有利于增大反应速率又有利于提高CO转化率的是_____________。
| A.随时将CH3OH与反应混合物分离 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.使用高效催化剂 |
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:

①在上述三种温度中,曲线Z对应的温度是
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)  CH3OH(g)的平衡常数 K= 。
CH3OH(g)的平衡常数 K= 。
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| |
0min |
5min |
10min |
| CO |
0.1 |
|
0.05 |
| H2 |
0.2 |
|
0.2 |
| CH3OH |
0 |
0.04 |
0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示。请认真观察下图,然后回答问题。

(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)环境先提供能量,该反应的△H= (用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g) =H2O(g) △H= -241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则其逆反应的活化能为 。
(3)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能 ,单位体积内活化分子的百分数 ,因此反应速率 ,(前面的三个空填“增大”“减小”“不变”)你认为最可能的原因是 。
试题篮
()