由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
(1)写出该反应的热化学方程式 。
(2)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为: 。
(4)温度降低,平衡常数K (填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
(6)下列措施中能使 增大的有 。
增大的有 。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.体积不变,充入He(g)使体系总压强增大
工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g) CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。
请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
| 实验组 |
T/℃ |
起始浓度/mol•L-1 |
等质量催化剂的 比表面积/m2•g-1 |
|
| CO |
H2 |
|||
| ① |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| ② |
280 |
1.20×10-3 |
5.80×10-3 |
124 |
| ③ |
350 |
|
|
124 |
其中设计实验组①和②的目的是______。
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2> p1)的曲线。
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。
已知A(g)+B(g)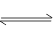 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。
则6s时c(A)= mol·L-1, C的物质的量为 mol;
若反应经一段时间后,达到平衡时A的转化率为 ,
如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)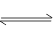 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。宇宙火箭和导弹中,大量用钛代替钢铁。
(1)Al的离子结构示意图为 ;
Al与NaOH溶液反应的离子方程式为
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,
其反应方程式为
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12 HCl(g) △H<0
Si3N4(s) + 12 HCl(g) △H<0
在恒温、恒容时,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得HCl(g)为0.3mol/L、 N2为0.05 mol/L
① H2的平均反应速率是
② 反应前与达到平衡时容器内的压强之比=
③ 系数 x =
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH1=+140 kJ·mol-1
C(s)+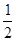 O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
。
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:
N2O4(g)(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。
(2)前10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min);反应进行至25 min时,曲线发生变化的原因是____________________________________________。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是________。
| A.加入催化剂 |
| B.缩小容器体积 |
| C.升高温度 |
| D.加入一定量的N2O4 |
试题篮
()