(15分)二氧化碳的过度排放会引发气候问题,而进行有效利用则会造福人类,如以CO2和NH3 为原料合成尿素。经研究发现该反应过程为:
①CO2(g)+2NH3(g) NH2COONH4(s) △H1
NH2COONH4(s) △H1
②NH2COONH4(s) CO(NH2)2(s)+H2O(g) △H2>0
CO(NH2)2(s)+H2O(g) △H2>0
请回答下列问题:
(1)研究反应①的平衡常数(K)与温度(T)的关系,如图1所示,则△H1____0。(选填“>”、“<”或“=”)。
(2)有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图2所示,现将3molNH3和2molCO2放入容器中,移动活塞至体积V为3L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
测定不同条件、不同时间段内的CO2的转化率,得到如下数据:
| CO2的转化率T(℃) |
10min |
20min |
30min |
40min |
| T1 |
30% |
65% |
75% |
75% |
| T2 |
45% |
50% |
a1 |
a2 |
①T1℃下,l0min内NH3的平均反应速率为__________。
②根据上表数据,请比较T1_________T2(选填“>”、“<”或“=”);T2℃下,第30min时,a1=________,该温度下的化学平衡常数为_________。
③T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人3molCO2,此时v(正)_____v(逆)(选填“>”、“<”或“=”),判断的理由是______。
(3)请在下图中补画出合成氨总反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、 生成物CO(NH2)2(s)+H2O(g)〕。
CO(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、 生成物CO(NH2)2(s)+H2O(g)〕。
煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)=2CO2(g) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
则反应CO(g)+2H2(g)=CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。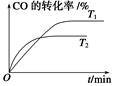
①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。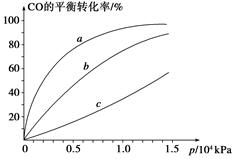
③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g)CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。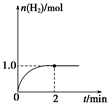
0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g)CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
A.平衡常数 B.CH3OH的平衡浓度
C.达到平衡的时间 D.平衡时气体的密度
27.氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。试回答下列问题:
(1)N2和H2为原料合成氨气的反应为:N2(g)+3H2(g) 2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号) 。
2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,则反应速率v(N2)= mol/(L·min)。
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) △H>0
2NO2(g) △H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0-t5时,容器内NO2的体积分数在t3-t4时值的最大
(4)氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式: 。
(5)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
(6)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是 .从理论上分析,该电池工作过程中 (填“需要”或“不需要”)补充碱(KOH).
大气中的部分碘源于O3对海水中Iˉ的氧化。将O3持续通入NaI酸性溶液溶液中进行模拟研究。
(1)O3将Iˉ氧化成I2的过程可发生如下反应:
①Iˉ(aq)+ O3(g)= IOˉ(aq) +O2(g)△H1
②IOˉ(aq)+H+(aq)  HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + Iˉ(aq) + H+(aq) I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
④O3(g)+2Iˉ(aq)+2H+(aq)= I2(aq) + O2(g)+ H2O(l) △H4
则△H3与△H1、△H2、△H4之间的关系是:△H3 = 。
(2)在溶液中存在化学平衡: I2(aq) + Iˉ(aq)  I3ˉ(aq)其平衡常数表达式为 。在反应的整个过程中I3ˉ物质的量浓度变化情况是 。
I3ˉ(aq)其平衡常数表达式为 。在反应的整个过程中I3ˉ物质的量浓度变化情况是 。
(3)为探究温度对I2(aq) + Iˉ(aq) I3ˉ(aq) △H5 反应的影响。在某温度T1下,将一定量的0.2 mol·L-1NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与 Iˉ反应),在t时刻,测得容器中I2(g)的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得I2(g)浓度,得到趋势图(见图一)。则:
I3ˉ(aq) △H5 反应的影响。在某温度T1下,将一定量的0.2 mol·L-1NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与 Iˉ反应),在t时刻,测得容器中I2(g)的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得I2(g)浓度,得到趋势图(见图一)。则:
①若在T3时,容器中无O3, T4~T5温度区间容器内I2(g)浓度呈现如图一所示的变化趋势,则△H5 0(填>、=或<);该条件下在温度为T4时,溶液中Iˉ浓度随时间变化的趋势曲线如图二所示。在t2时,将该反应体系温度上升到T5,并维持该温度。请在图2中画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线。
②若在T3时,容器中还有O3,则T1~T2温度区间容器内I2(g)浓度呈现如图一所示的变化趋势,其可能的原因是 。(任写一点)
(4)利用反应④和图2的信息,计算0-t1时间段内用I2(aq)表示的化学反应速率 。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与N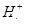 具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。
具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。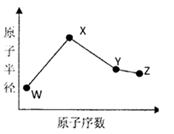
(1)Y在周期表中的位置是 。
(2)用电子式表示化合物X3W的结构 。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是 。
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则a b(填“>”或“<”或“=”)。
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是 。
(6)已知W的单质与气体B在一定条件下可形成气体A,即: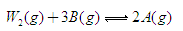 △H=—92.4kJ·mo1-1
△H=—92.4kJ·mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 |
浓度(mo1/L) |
||
| c(W2) |
c(B) |
c(A) |
|
| 第0 min |
4.0 |
9.0 |
0 |
| 第10 min |
3.8 |
8.4 |
0.4 |
| 第20 min |
3.4 |
7.2 |
1.2 |
| 第30 min |
3.4 |
7.2 |
1.2 |
| 第40 min |
3.6 |
7.8 |
0.8 |
①0min~10min,W2的平均反应速率 。
②反应在第l0min改变了反应条件,改变的条件可能是 。
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是 。
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度
甲醇是一种重要的化工原料。甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。现有如下实验,在体积为1 L的密闭容器中,充入1mol CH3OH和1molH2O,一定条件下发生反应:CH3OH (g)+ H2O (g) CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
| 时间 物质 |
0 min |
10 min |
30 min |
60 min |
70 min |
| CO2(mol/L) |
0 |
0.2 |
0.6 |
0.8 |
0.8 |
| CH3OH(mol/L) |
1.0 |
0.8 |
0.4 |
0.2 |
0.2 |
①已知:CH3OH (g)+ 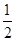 O2 (g)
O2 (g) CO2(g) + 2H2 (g) H1= —192.9kJ/mol
CO2(g) + 2H2 (g) H1= —192.9kJ/mol
H2(g)+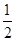 O2 (g)
O2 (g) H2 O(g) H2= —120.9kJ/mol
H2 O(g) H2= —120.9kJ/mol
则甲醇与水蒸气催化重整反应的焓变△H3=_____ 。
②10~30 min内,氢气的平均反应速率v(H2)=___________mol/(L·min)。
③该反应的平衡常数表达式为K=__________________。
④下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.再充入1molH2O
(2)甲醇在催化剂条件下可以直接氧化成甲酸。
①在常温下,用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)___(填“<”或“>”或“=”) 20. 00 mL。
②在上述滴定操作中,若将甲酸换成盐酸,请在图中的相应位置画出相应的滴定曲线。(1滴溶液约0.04mL) 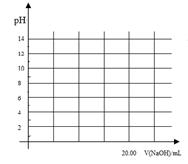
从图表中获得有用的信息是化学学习和研究的重要能力。
(1)图1是在一定条件下,反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)的实验曲线。
2CO(g)+2H2(g)的实验曲线。
①图中P1、P2、P3、P4代表不同压强,则压强大小的排列顺序为 。该反应的△H 0(选填“>”、“<”、“=”)。
②压强为 P4时,在 Y 点:υ(正) υ(逆)。(选填“>”、“<”、“=”);
③压强为P4时,密闭容器中CH4和CO2的起始浓度均为0.10mol•L-1,则1100℃时该反应的化学平衡常数
为 (保留三位有效数字)。
(2)温度与HCl压强对MgCl2·6H2O受热分解产物的影响如图所示,下列说法正确的是
| A.温度低于100℃,MgCl2·6H2O不会发生分解 |
| B.要得到MgO温度至少需要加热至600℃ |
| C.要得到无水MgCl2只要控制温度,不一定要在HCl气体中 |
| D.在HCl气体压强为0.25×106Pa时,温度由室温升高至300℃,发生的反应为MgCl2·6H2O=Mg(OH)Cl+HCl+5H2O |
(3)X-射线衍射可用于判断某晶态物质是否存在。Al-LiBH4是新型产氢复合材料,常温下可以与H2O反应生成H2。图3是含LiBH4为25%时Al-LiBH4复合材料的X-射线衍射图谱,图4是该复合材料在25℃(图谱a)和75℃(图谱b)时与水反应后残留固体物质的X-射线衍射图谱。据图分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是__ (填化学式),25℃和75℃时产物中不相同的物质是_ _ (填化学式)。

氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=―92.40 kJ·mol-1
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=―159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H=+72.49 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为 。
(2)用丙烷和水为原料在电催化下制氢气,同时得到一种含有三元环的环氧化合物A,该反应的化学方程式为 。该反应也可生成A的同分异构体——另一种环氧化合物B,B的核磁共振氢谱为下图中的 (填“a”或“b”)。
(3)已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑
2HN3+Zn=Zn(N3)2+H2↑
2 mol HN3与一定量Zn完全反应,在标准状况下生成67.2 L气体,其中N2的物质的量为 。
(4)已知H2S高温热分解制H2的反应为:H2S(g) H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
(5)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l)=CO2(g)+2H2(g)现将一定量的1 mol·L-1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL-1~0.12g·mL-1的煤浆液,置于右图所示装置中进行电解(两电极均为惰性电极)。则A极的电极反应式为 。
随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9 mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9 mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂3 mol H-H键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、 脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。
则0~10 min内,氢气的平均反应速率为 _______mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
| n(SO32﹣)︰n(HSO3﹣) |
91︰9 |
1︰1 |
9︰91 |
| pH |
8.2 |
7.2 |
6.2 |
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c.c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)
(4)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有 生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:C (s)+H2O (g)  CO(g)+H2(g) ΔH = +131.4 kJ/mol
CO(g)+H2(g) ΔH = +131.4 kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密度增大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为_________________________。
(2)关于上述反应在化学平衡状态时的描述正确的是 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如右图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:
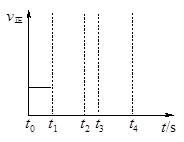
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol,283.0 kJ/mol,水的摩尔蒸发焓为44.0 kJ/mol,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
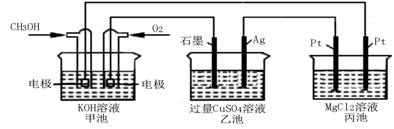
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为 。当甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得。实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75∶2);②在碳存在下,X与N2反应生成AlN。请回答:
(1)X的化学式为 。
(2)碳热还原制备氮化铝的总反应化学方程式为:
Al2O3(s)+3C(s)+N2(g) 2AlN(s)+3CO(g)
2AlN(s)+3CO(g)
①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如下图曲线甲所示。下列说法不正确的是 。

A.从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率
B.c点切线的斜率表示该化学反应在t时刻的瞬时速率
C.在不同时刻都存在关系:v(N2)=3v(CO)
D.维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙
②一定温度下,在压强为p的反应体系中,平衡时N2的转化率为α,CO的物质的量浓度为c;若温度不变,反应体系的压强减小为0.5p,则N2的平衡转化率将 α(填“<”、“=”或“>”),平衡时CO的物质的量浓度 。
A.小于0.5c B.大于0.5c,小于c
C.等于c D.大于c
③该反应只有在高温下才能自发进行,则随着温度升高,反应物Al2O3的平衡转化率将 (填“增大”、 “不变”或“减小”),理由是 。
(3)在氮化铝中加入氢氧化钠溶液,加热,吸收产生的氨气,进一步通过酸碱滴定法可以测定氮化铝产品中氮的含量。写出上述过程中氮化铝与氢氧化钠溶液反应的化学方程式 。
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2 kJ,用H2表示的平均速率为 。
(2)合成氨厂可用反应CO(g)+H2O(g) H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
①在800℃发生上述反应,向恒容反应器投入CO2、H2、CO、H2O的物质的量分别为:1 mol、1 mol、2 mol、2 mol,此时该反应由 反应方向开始建立平衡。(选填“正”或“逆”)。
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为 。
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有___________;
a.增加CO的用量 b.增加H2O(g)的用量
c.增大压强 d.降低温度
800℃、2L密闭容器反应2NO(g)+O2(g) 2NO2(g)体系中, n(NO)随时间的变化如表:
2NO2(g)体系中, n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
计算并回答下列问题:
(1)反应进行到2 s时c (NO)= 。
(2)用O2表示从0~2s内该反应的平均速率υ=___________。
(3)反应达到平衡状态时NO的转化率= 。(提示: )
)
(4)判断一可逆反应是否达到平衡状态的依据有很多,某同学针对该反应提出一种设想:测定容器内气体的密度,当密度不再改变时即可判断出该反应已经达到平衡状态。你认为这种设想是否正确? (填“是”或“否”)请说明你的理由 。
Ⅰ.在一定条件下,xA+yB zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向______移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为______。
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
(1)图中共有两条曲线X和Y,其中曲线_______表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是__________。下列不能说明该反应已达到平衡状态的是___________。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均分子质量不随时间变化而改变
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=_______mol·L-1·min-1。
② 0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数K1=_______。
N2O4(g)的平衡常数K1=_______。
③ 25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数K2_____K1(填“>”、“=”或“<”)。
N2O4(g)的平衡常数K2_____K1(填“>”、“=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是______________ (用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________。
A.加入催化剂 B.升高温度
C.缩小容器体积 D.加入一定量的N2O4
试题篮
()