某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强/kPa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓 度/mol·L-1 |
2.4×10-3 |
3.4×10-3 |
4.8×10-3 |
6.8×10-3 |
9.4×10-3 |
①可以判断该分解反应已经达到平衡的是_______________ 。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时的分解平衡常数:________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_________________ (填“增加”,“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH_______________0(填“>”、“=”或“<”),熵变ΔS________________0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O
NH4HCO3+NH3·H2O
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如下图所示。
⑤计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:________。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:______________ _______________________________。
苯硫酚(PhSH)是一种用途广泛的有机合成中间体。工业上用常用氯苯(PhCl)和硫化氢(H2S)在高温下反应来制备苯硫酚,但会有副产物苯(PhH)生成。
I: PhCl(g)+H2S(g) PhSH(g)+HCl(g) △H1=—16.8kJ·mol-1
PhSH(g)+HCl(g) △H1=—16.8kJ·mol-1
II: PhCl(g)+H2S(g) ==PhH(g)+ HCl(g)+ S8(g) △H2
S8(g) △H2
回答下列问题:
(1)反应I为可逆反应,写出平衡常数的表达式K=_______________________,
反应II为不可逆反应,△H2=___________0。(填写“>”,“<”,“=”)

(2)上述两个反应的能量变化如图一所示,则在某温度时反应速度v(I)__________v(II)(填写“>”,“<”,“=”)
(3)现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20分钟测定生成物的浓度,得到图二和图三。
①请解释图二中两条曲线的变化_______________________。
②若要提高主产物苯硫酚的产量,可采取的措施是______________________。
(4)请根据图二、图三,画出恒温恒容条件下反应主产物苯硫酚的物质的量随时间变化的曲线图。

(7分) 固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。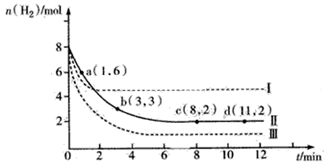
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡时CO2的转化率 。
(4)在恒温恒容的条件下,下列能说明该反应已经达到平衡状态的是_______。
A.K不变 B.容器内压强保持不变
C.v正(H2)=3v正(CO2) D.容器内的密度保持不变
(5)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅲ对应的实验条件改变是 。
A.升高温度
B.增大压强
C.加入的催化剂
D.降低温度
E.减小压强
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。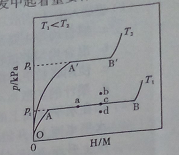
在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)==ZMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=_____(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=______mL•g-1•min。反应的焓变△HⅠ_____0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____ η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的_____点(填“b”“c”或“d”),该贮氢合金可通过______或_______的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为_________。已知温度为T时:CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41KJ•mol
硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
(1)①5分钟时O2的反应速率是_________;
②列式并计算该条件下反应的平衡常数K=___________。
③已知:K(300℃)>K(350℃),若反应温度升高,SO2的转化率_______(填“增大”、“减小”或“不变”)。
④能判断该反应达到平衡状态的标志是____________。(填字母)
A.SO2和SO3浓度相等
B.容器中混合气体的平均分子量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)___________K(B)(填“>”、“<”或“=”)。
(3)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
以化学反应原理为依据,以实验室研究为基础,可以实现许多化工生产。
I分解水制取氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应:
分析上述反应,下列判断正确的是____。
循环过程中产生1 的同时产生
的同时产生
反应①中 还原性比
还原性比 强
强
循环过程中需补充
反应③易在常温下进行
在一定温度下,向2L密闭容器中加入 ,发生反应②.物质的量随时间的变化如图所示。
,发生反应②.物质的量随时间的变化如图所示。 内的平均反应速率
内的平均反应速率
 的转化率=_______
的转化率=_______
恒温恒容条件下,硫发生转化的反应过程和能量关系如图所示。 请回答下列问题:
请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式_______;
②恒温恒容时, 和
和 充分反应,放出热量的数值比
充分反应,放出热量的数值比 _____(填“大”、“小”或“相等”)
_____(填“大”、“小”或“相等”)
II.氮化硅( )是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
)是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
该反应平衡常数的表达式为K=_______.升高温度,其平衡常数
_________(填“增大”、“减少”或“不变”)。
(2)该化学反应速率与反应时间的关系如图所示
 时引
时引 起突变的原因是_____,
起突变的原因是_____, 引起变化的因素是_____,
引起变化的因素是_____, 时引
时引 小变化、
小变化、 大变化的原因是_________.
大变化的原因是_________.
试题篮
()