氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下: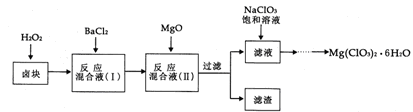

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
回答下列问题:
(1)加速卤块在H2O2溶液中溶解的措施有: (写出一条即可)。
(2)加入MgO的作用是 ;滤渣的主要成分为 。
(3)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为①蒸发结晶;② ;③____;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为: 。
。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-): ;
②产品中Mg(ClO3)2·6H2O的质量分数为(保留一位小数) 。
复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2。
(1)H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置。
若利用甲实验,可通过观察________现象,从而定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________;若利用乙实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
(2)在含有表面活性剂的酸性水溶液中,以碳为电极,通直流电进行电解可制取氢气和过氧化氢,过氧化氢在 (填“阴极”、“阳极”)产生。
以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃料电池,可用作通信卫星电源。其工作原理如图所示,写出a极上的电极反应式: ,正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为 
(3)锗(Ge)与碳是同主族元素,最新研究表明有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应,但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其化学方程式为 。
【化学——选修2:化学与技术】(15分)
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作辅助剂,在化学工业和制药工业中也可作氧化剂,应用领域十分广泛。实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量铝的氧化物)通过以下过程来制取。
回答下列问题:
(1)步骤Ⅰ中反应化学方程式为___FeO·Cr2O3+___Na2CO3+___O2===___Na2CrO4+___Fe2O3+___CO2。在常温下该反应速率极慢,下列措施中能使反应速率增大的是________(填字母序号)。
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅲ需将溶液的pH调至7~8,并煮沸,其目的是________________________。
(3)步骤Ⅳ中发生反应的离子方程式为________________________________________。
(4)利用下面的复分解反应,将红矾钠与KCl固体按1∶2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl===K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)。基本实验步骤为①溶解;②________;③________;④冷却、结晶,再过滤得K2Cr2O7晶体。其中③应在_________________(填“高温”或“低温”)条件下进行。
(14分) (1)在恒温,容积为1 L恒容中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式:________________________________
______________________________________________________________________。
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为______________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是________(填序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) 2H2+O2
2H2+O2
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O(g) CO+3H2
CO+3H2
②CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
③能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即
图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)  CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
请回答下列问题:
(1)分别用浓、稀硝酸溶解等量的两份铜粉,消耗硝酸的物质的量较少的是_________硝酸(填“浓”或“稀”),相应的离子方程式是_____________.
(2) 800 时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g)
时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。
2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。
②该条件下,2NO(g)+O2(g) 2NO2(g)的△H= 。
2NO2(g)的△H= 。
③若向平衡混合物中再充入NO、NO2各1mol,此时v正 v逆(填“>”、“=”或“<”)。
④若向平衡混合物中仅充入lmolNO2,平衡向_______(填“正向”、“逆向”或“不”)移
动。达新平衡时,NO2的体积分数________(填“增大”、“减小”或“不变”)。
(3)染料工业排放的废水中含有大量有毒的NO2-,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式________
大气中的部分碘源于对海水中
的氧化。将
持续通入
溶液中进行模拟研究。
(1)将
氧化成
的过程由3步反应组成:
①
②
③
总反应的化学方程式为,其反应=。
(2)在溶液中存在化学平衡:,其平衡常数表达式为。
(3)为探究对氧化
反应的影响(反应体系如图13),某研究小组测定两组实验中
浓度和体系
,结果见图14和下表。


| 编号 |
反应物 |
反应前 |
反应后 |
| 第1组 |
5.2 |
11.0 |
|
| 第2组 |
5.2 |
4.1 |
①第1组实验中,导致反应后升高的原因是。
②图13中的为。由
生成
的过程能显著提高
的转化率,原因是。
③第2组实验进行18后,
下降。导致下降的直接原因有(双选)。
A.减小 B.
减小 C.
不断生成 D.
增加
(4)据图14,计算3~18内第2组实验中生成
的平均反应速率(写出计算过程,结果保留两位有效数字)。
光气()在塑料、制革、制药等工业中有许多用途,工业上采用高温下
与
在活性炭催化下合成。
(1)实验室常用来制备氯气的化学方程式为
(2)工业上利用天然气(主要成分为)与
进行高温重整制备
,已知
、
、和
的燃烧热(
)分别为-890.3
、-285.8
和-283.0
,则生成1
(标准状况)
所需热量为
(3)实验室中可用氯仿()与双氧水直接反应制备光气,其反应的化学方程式为
(4)的分解反应为
。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10
到14
的
浓度变化曲线未示出):

①计算反应在第8时的平衡常数
=
②比较第2反应温度
(2)与第8
反应温度
(8)的高低:
(2)
(8)
(填"<"、">"或"="),
③若12时反应于温度
(8)下重新达到平衡,则此时
=
;
④比较产物在2-3
、5-6
和12-13
时平均反应速率(平均反应速率分别以v(2-3)、v(5-6)、v(12-13))的大小
⑤比较反应物在5-6
和15-16
时平均反应速率的大小:v(5-6)v(15-16)(填"<"、">"或"="),原因是
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
3 mol/L 稀硫酸 |
0.05mol/L KMnO4溶液 |
||
| 1 |
3.0 |
2.0 |
2.0 |
3.0 |
1.5 |
| 2 |
2.0 |
3.0 |
2.0 |
3.0 |
2.7 |
| 3 |
1.0 |
4.0 |
2.0 |
3.0 |
3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
再向试管中加入少量固体 |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
3 mol/L 稀硫酸 |
0.05 mol/L KMnO4溶液 |
|||
| 4 |
3.0 |
2.0 |
2.0 |
3.0 |
|
t |
③若该小组同学提出的假设成立,应观察到的现象是 。
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为 ;总方程式为 。
高铁酸钠(Na2FeO4)具有很强的氧化性,广泛应用于净水、电池工业等领域。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下,回答下列问题:
已知:NaClO不稳定,受热易分解。
(1)粗FeO酸溶过程中通入水蒸气(高温),其目的是__________________________。
(2)操作I目的是得到高纯度FeSO4溶液,则氧化I中反应的离子方程式为_________。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备
①Cl2与NaOH溶液反应的离子方程式为_________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/℃ |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
| NaClO浓度/mol·L-1 |
4.6 |
5.2 |
5.4 |
5.5 |
4.5 |
3.5 |
2 |
请描述随温度变化规律________________________________________________________。
其原因为____________________________________________________________________。
(4)工业也常用电解法制备Na2FeO4,其原理为Fe+2OH-+2H2O电解FeO42-+3H2↑。请用下列材料设计电解池并在答题卡的方框内画出该装置。
可选材料:铁片、铜片、碳棒、浓NaOH溶液、浓HCl等
其阳极反应式为:________________________________。
2SO2(g)+ O2 (g)  2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
| 温度/℃ |
400 |
500 |
600 |
| SO2转化率/% |
99.2 |
93.5 |
73.7 |
(1)该反应是______反应(填“放热”或“吸热”)。
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是______mol。
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是______(填序号)。
a. c + c(NH3•H2O)=" 2[c()+" c()+ c(H2SO3)]
b. c()+ c(H+)=" c()+" c()+ c(OH-)
c. c()> c() > c(OH-) > c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4。
i. 得到MnSO4的化学方程式是______。
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙。 

图甲中pH变化是因为吸收中有部分SO2转化为H2SO4,生成H2SO4反应的化学方程式是______;由图乙可知pH的降低______SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是______。
Ⅰ.分类法是化学学习的一种十分有效的方法,它可以使我们从不同角度对同一知识做更加深入的了解,人们根据不同的标准,即使同一物质也可能被划在不同的类别中。现有如下物质①MgCl2②HCl ③SO2 ④ NO2 ⑤K2CO3 ⑥ Cl2 ⑦CaO ⑧ NaOH
请根据下列标准,对上述物质进行分类:
(1)既含离子键又含共价键的物质是 (填代号,下同)。
(2)只含共价键且为非电解质的是 。
(3)含有共价键的化合物是 。
Ⅱ.向某恒容的密闭容器中加入A、B、C三种气体,如图所示是一定条件下三种气体的物质的量随时间的变化情况。
(1)写出该密闭容器发生反应的化学方程式为 。
(2)2分钟后A、B、C各物质的量不再随时间的
变化而变化,其原因是____ 。
(3)下列情况能说明该反应达到化学反应限度的是 。
A.该容器的压强不再发生变化;
B.单位时间内生成A的物质的量与生成C的物质的量相同;
C.该容器中气体的密度不再改变;
D.容器中A的物质的量与C的物质的量相同
向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示 (气体体积均在标准状况下测定)。请回答下列问题:
(气体体积均在标准状况下测定)。请回答下列问题:
(1)设OE段的反应速率为v1,EF段的反应速率为v2,
FG段的反应速率为v3,则 影响v1、v2、v3反应速率的因素是 ;
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 (填字母)
| A.蒸馏水 | B.氯化钾固体 | C.氯化钠溶液 | D.浓盐酸 |
 (3)加入CaCO3的质量为 。
(3)加入CaCO3的质量为 。
(4)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率V(HCl)=______。
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
(1)0~a,a~b,b~c,c~d四段中,平均反应速率最大的时间段是___________ ,该时间段内H2的平均反应速率是_____________。
(2)平衡时CO2的转化率是多少?反应前后容器内的压强比时多少?(请按计算题格式在答题卡上作答)
L)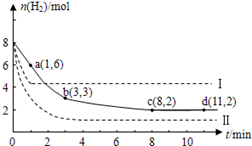
氮的固定有三种途径:生物固氮、自然固氮和工业固氮。根据最新“人工固氮”的研究报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间1 h):
| T/K |
303 |
313 |
323 |
353 |
| NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的化学方程式:2N2(g)+6H2O(l)  4NH3(g)+3O2(g)ΔH=a kJ·mol-1
4NH3(g)+3O2(g)ΔH=a kJ·mol-1
回答下列问题:
(1)此合成反应的a________0;ΔS________0,(填“>”、“<”或“=”)
(2)已知:N2(g)+3H2(g)  2NH3(g) ΔH=-92 .4 kJ·mol-1
2NH3(g) ΔH=-92 .4 kJ·mol-1
2H2(g)+O2(g) ===2H2O(l) ΔH =-571.6 kJ·mol-1
则2N2(g)+6H2O(l)===4NH3(g)+3O2 (g) ΔH=________kJ·mol-1
(3)从323 K到353 K,氨气的生成量减少的可能原因_________________;
(4)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
①在上述三种温度中,曲线X对应的温度是________。
②a、b、c三点H2的转化率最小的是________点、转化率最大的是________点。
③在容积为1.0 L的密闭容器中充入0.30 mol N2(g)和0.80 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。该条件下反应2NH3(g)  N2(g)+3H2(g)的平衡常数为________ 。
N2(g)+3H2(g)的平衡常数为________ 。
近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。在密闭容器
2CO2(g)+ N2(g)。在密闭容器
中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是 (填字母编号)。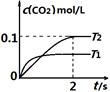
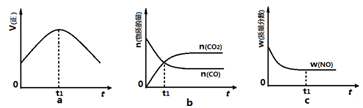
图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g) N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。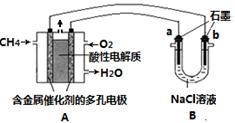
①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为 L。
试题篮
()