对于反应A(g)+3B(g) 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.02 mol/(L·s) B.v(B)=0.03 mol/(L·s)
C.v(B)=0.90 mol/(L·min) D.v(C)=0.60 mol/(L·min)
对于反应:CaCO3+2HCl=CaCl2+H2O+CO2↑,下列说法正确的是
| A.用HCl和CaCl2表示的反应速率数据不同,但所表示的意义相同 |
| B.不能用CaCO3的浓度变化来表示反应速率,但可用水来表示 |
| C.用H2O和CO2表示的化学反应速率相同 |
| D.用CaCl2浓度的减小表示其反应速率 |
在2A+B 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(A)=0.5 mol/(L·s) B.v(B)= 0.3 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1 mol/(L·s)
在密闭容器中A与B反应生成C,一段时间内其化学反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B)=v(A),v(C)=3v(B),则此反应可表示为
A.2A+3B=2C B.A十3B="2C" C.2A+B=3C D.A+B=C
在一定条件下,反应N2+3H2 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
| A.v(NH3)=0.02mol/(L· min) |
| B.v(N2)=0.005mol /(L· min) |
| C.v(NH3)=0.17mol/(L· min) |
| D.v(H2)=0.03mol/(L· min) |
实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g) 2C(g);△H =QkJ/mol
2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
| 实验 序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
8 0 0 ℃ |
n2 |
0.60 |
0. 50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= 实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是

a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的  。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的
。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的  。
。
①a、b、c必须满足的关系是 (一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是
有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
2C(g),△H<0。
(1)若将4 mol A和2 mol B在2 L的容器中混合,经2 s后测得C的浓度为0.6 mol/L,用物质A表示的平均反应速率为_____;2s时物质B的浓度为__________;
(2)若将4 mol A和2 mol B加入体积不变的容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2 mol。此时,混合气体中C的体积分数为__________;若再通入少量B气体,体系中A的物质的量_________(填“增大”、“减小”或“不变”),若要使A的物质的量再达到与原平衡状态相同,可采取的三种措施有 、 、
在2A+B  3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(A)=0.5 mol·L-1·s-1
B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1
D.v(D)=1.6 mol·L-1·min-1
下列关于反应N2 + 3H2 2NH3的反应速率说法一定正确的是
2NH3的反应速率说法一定正确的是
| A.每消耗1molN2的同时消耗2molNH3 |
| B.相同时间内消耗28gN2与消耗6gH2的反应速率相同 |
C.当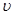 (N2)=3 (N2)=3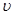 (H2)时表示反应已达平衡 (H2)时表示反应已达平衡 |
D.2min内H2减少3mol,则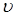 (N2)=0.5mol/(L·min) (N2)=0.5mol/(L·min) |
反应3A(g)+B(g) 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
A.v(A)=1.5 mol·L-1·s-1
B.v(C)=0.5 mol·L-1·s-1
C.v(D)=0.6 mol·L-1·s-1
D.v(B)=0.4 mol·L-1·s-1
在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B) 、v(C)表示。已知v(A)、v(B) 、v(C)之间有以下关系2v(B)="3" v(A), 3v(C)="2" v(B)则此反应可表示为
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
已知4NH3 +5 O2 ="4NO" + 6H2O ,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)、表正确的关系是
| A.4/5v(NH3) = v(O2) |
| B.5/6v(O2) = v(H2O) |
| C.2/3v(NH3) = v(H2O) |
| D.4/5 v(O2) = v(NO) |
反应2SO2(g)+O2 2SO3(g)经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为
2SO3(g)经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为
| A.0.1 s | B.2.5s | C.10s | D.5s |
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是
xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是
A.x的值为1
B.用B的浓度变化表示的平均反应速率为0.2 mol·L-1·min-1
C.反应开始前A的物质的量为3 mol
D.5 min时A的浓度为0.2 mol·L-1
试题篮
()