下列实验不能获得成功的是
| |
实验目的 |
实验步骤 |
| A. |
探究催化剂对化学反应速率的影响 |
向H2O2溶液中滴加少量FeCl3溶液 |
| B. |
探究乙醇能发生氧化反应 |
将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C. |
探究石蜡油分解的产物不都是烷烃 |
将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D. |
探究蔗糖水解的产物中是否含有葡萄糖 |
取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热 |
已知分解1 mol H2O2 放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:
第一步:H2O2+I-→ H2O +IO-(慢);
第二步:H2O2+IO-→ H2O +O2+ I-(快)
下列有关反应的说法正确的是
| A.I-和IO-都是该反应的催化剂 |
| B.H2O2分解的速率取决于第二步反应的快慢 |
| C.反应物的总能量比生成物总能量低98kJ |
| D.第一步H2O2被还原,第二步H2O2被氧化 |
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
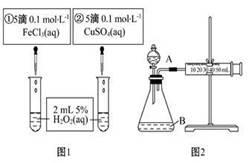
| A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间 |
| D.为检查图2装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原 |
反应mA(s)+nB(g)  pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如右图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如右图所示,下列叙述中一定正确的是

①m+n>p ②x点表示的正反应速率大于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
| A.①②⑤ | B.只有②④ |
| C.只有①③ | D.①③⑤ |
为了说明影响化学反应快慢的因素,甲、乙、丙、丁4位同学分别设计了如下4个实验,你
认为结论不正确的是
| A.将形状、大小均相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样 |
| B.在相同条件下,等质量的大理石块和粉末与相同浓度的盐酸反应,大理石粉末反应快 |
| C.常温下将浓硝酸分别放在阴暗处和强光照射下,发现光照可加快浓硝酸的分解 |
| D.两只试管中分别加入相同质量的氯酸钾,其中一只试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
A.在t1min时,3V正(B)=2V逆(C)
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
工业上用H2和N2直接合成氨:N2+3H2=2NH3,下列措施肯定能使合成氨反应速率加快的是:
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④增大压强
| A.只有①②③ | B.只有①②④ | C.只有①③④ | D.①②③④ |
在容积相同的两个密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol HI(a>b),可逆反应2HI  H2+I2(g)达到平衡后,下列说法正确的是
H2+I2(g)达到平衡后,下列说法正确的是
A.开始时A容器中的反应速率大于B容器中的反应速率
B.平衡时c(I2)A=c(I2)B
C. HI的平衡分解率:αA>αB
D.平衡时,I2蒸气在混合气体中的体积分数:A容器>B容器
一定条件下,通过下列反应可以制备特种陶瓷的原料,

。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标
随
变化趋势合理的是()

| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
||
| C |
平衡常数 |
|
| D |
用CaCO3与稀盐酸反应制取CO2,部分时间段内产生气体的体积如图所示,下列说法正确的是
| A.OE段化学反应速率最快 |
| B.EF段收集CO2气体最多 |
| C.为了加快反应速率,可向溶液中滴入硫酸铜溶液 |
| D.分析OE、EF、FG三段,该反应为放热反应 |
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、
KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是
| A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1 |
| C.图中b、c两点对应的NaHSO3反应速率相等 |
| D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂 |
一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如图所示。下列判断不正确的是
| A.该实验方案的缺陷之一是未做空白对照实验 |
| B.Cu2+、Mn2+提高乙酸降解速率的最佳浓度为0.1 mmol·L-l |
| C.Fe3+不能提高乙酸降解速率 |
| D.相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小 |
已知分解1mol H2O2放出热量98kJ。在含有少量I-的溶液中,H2O2分解的机理为:
H2O2+ I-→H2O+IO- 慢 H2O2+ IO-→H2O+O2+ I- 快
下列有关该反应的说法正确的是
| A.反应速率与I-浓度有关 | B.IO-也是该反应的催化剂 |
| C.反应活化能等于98kJ/mol | D.v(H2O2)=v(H2O)=v(O2) |
下列相关实验能达到预期目的的是( )
| |
相关实验 |
预期目的 |
| A |
相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 |
验证固体接触面积对化学反应速率的影响 |
| B |
可逆反应FeCl3(aq)+3KSCN(aq) Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 |
验证浓度对化学平衡的影响 |
| C |
室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 |
验证BaSO4和BaCO3Ksp的相对大小 |
| D |
相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 |
验证不同催化剂对H2O2分解速率的影响 |
试题篮
()