下列图示与对应的叙述相符的是
| A.图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B.图2表示0.1 mol·L-1CH3COOH溶液滴定20.00mL0.1 mol·L-1NaOH溶液所得到的滴定曲线 |
C.图3表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右 |
某学生欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量。其实验过程如图所示:

(1)步骤①所加的A的化学式为 ;已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则加入A调pH范围是_____ ___ (已知lg2=0.3)
(2)步骤②中所用的部分仪器如右图:则A应接在直流电源的 极(填“正”或“负” )。

(3)石墨电极上的电极反应式 。
(4)下列实验操作中必要的是(填字母) 。
| A.称量电解前电极的质量 |
| B.电解后,电极在烘干称重前,必须用蒸馏水冲洗 |
| C.刮下电解后电极上析出的铜,并清洗、称重 |
| D.电极在烘干称重的操作中必须按“烘干→称重→再烘干→再称重”进行 |
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为 (用带有n、V的计算式表示)。
(6)若②用甲醇—O2—熔融碳酸盐电池提供电能,写出该电池负极的电极反应式
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示:
| |
CaSO4 |
CaCO3 |
MgCO3 |
Mg(OH)2 |
CuS |
BaSO4 |
H2S |
H2CO3[] |
| KSP或Ka |
9.1х10-6 |
2.8х10-9 |
6.8х10-6 |
1.8х10-11 |
6.3х10-36 |
1.1х10-10 |
Ka1=1.3х10-7 Ka2=7.1х10-15 |
Ka1=4.4х10-7 Ka2=4.7х10-11 |
则下列说法不正确的是
A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4
B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+===CuS↓+H+
C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理
D.在Mg(HCO3)2溶液中滴加澄清石灰水发生反应的离子方程式为Mg2++2HCO+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O
葡萄酒常用Na2S2O5做抗氧化剂。
(1)1.90g Na2S2O5最多能还原 mLO2(标准状况)。
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。
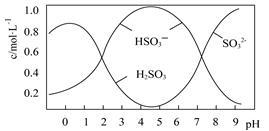
写出Na2S2O5溶解于水的化学方程式 ;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是 。
已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤ mol·L-1。
(3)葡萄酒样品中抗氧化剂的残留量测定(已知:SO2+I2+2H2O=H2SO4+2HI):准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分。取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol·L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL。重复以上操作,消耗标准I2溶液15.98mL。计算葡萄酒样品中抗氧化剂的残留量 (单位:mg·L-1,以SO2计算,请给出计算过程。)
已知25℃时,Ksp(Mg(OH)2)=1.8×10-11,Ksp(Cu(OH)2)=2.2×10-20。请按要求回答下列问题:
(1)在25℃下,向浓度均为0.1 mol・L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____________沉淀(填化学式),生成该沉淀的离子方程式为________________。
(2)25℃时,向0.01 mol・L-1的MgCl2溶液中,逐滴加入浓NaOH溶液,当Mg2+完全沉淀时,溶液的pH为_______________(忽略溶液体积变化,已知lg1.8=0.26)。
(3)已知25℃时,Ksp(Fe(OH)3)=2.79×10-39,试求该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K,写出计算推理过程。
Fe3++3H2O的平衡常数K,写出计算推理过程。
请按要求回答下列问题:
(1)将100mL 0.3mol·L-1的NaHSO4溶液和100mL 0.2mol·L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程式:____________________________;
若向反应后的溶液中滴加2-3滴酚酞试液,则溶液的颜色变为__________________;
(2)某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计。若所得混合溶液为中性,则a:b=_________________
(3)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17。则AgX、AgY、AgZ三者的溶解度(mol/L)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:____________________________;若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”“减小”或“不变”)。
下图表示的是难溶氢氧化物在不同pH下的溶解度(S/mol·L-1),下列说法中正确的是
| A.pH=3时溶液中铁元素的主要存在形式是Fe3+ |
| B.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右 |
| C.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去 |
| D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀 |
25℃时,几种酸的电离平衡常数如下:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数 |
1.8×10-5 |
Ka1= 4.3×10-7 Ka2= 5.6×10-11 |
3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol/L的下列四种溶液:a.Na2CO3溶液,b.NaClO溶液,c.CH3COONa溶液d.NaHCO3溶液;pH由大到小的顺序是:_______________________(填编号)。
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程中,下列各项的数值一定变小的是:__________。
A. c(H+) B. c(H+)/c(CH3COOH) C. c(H+)·c(OH-) D. c(OH-)/c(H+)
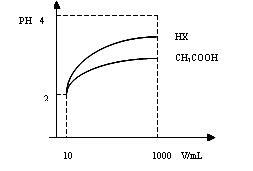
(3)体积均为10mL pH均为2的CH3COOH溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:稀释后, HX溶液中水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)
CH3COOH溶液中水电离出来的c(H+),理由是__________________________________。
(4)25℃时,测得CH3COOH与CH3COONa的混合溶液PH=6,则溶液中c(CH3COO-)- c(Na+)=_______________________。(填准确数值)
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)
| 难溶电解质 |
CaCO3 |
CaSO4 |
| Ksp |
2.8×10-9 |
9×10-6 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入足量Na2CO3固体,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④ 。
(1)步骤①所得悬浊液中c(Ca2+)=________ mol·L-1
(2)写出第②步发生反应的离子方程式:________________________________.
(3)请补充第④步操作及发生的现象________________________________________________.
(4)请写出该原理在实际生产生活中的一个应用 。
已知298K时,Mg(OH)2的溶度积常数为KSP=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
| A.所得溶液中c(H+)=10-13 mol/L |
| B.所加烧碱溶液的pH=13.0 |
| C.所得溶液中由水电离产生的c(OH-)=10-13 mol/L |
| D.所得溶液中c(Mg2+)=5.6×10-10 mol/L |
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是
| A.溴酸银的溶解是吸热过程 |
| B.温度升高时溴酸银溶解速度加快 |
| C.60 ℃时溴酸银的Ksp约等于6×10-3 |
| D.若硝酸钾中含有少量溴酸银,可用它们的溶解度随温度变化的差异进行分离 |
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
| A.Cl-、Br-、CrO42- | B.CrO42-、Br-、Cl- |
| C.Br-、Cl-、CrO42- | D.Br-、CrO42-、Cl- |
海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,最后电解得到金属镁。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]= 1.0×10-38。 当溶液中离子浓度≤1.0×10-5 mol·L-1可视为沉淀完全。
(1)有浓度为1.8×10-3mol·L-1的MgCl2溶液,该溶液中含有少量Fe3+,当溶液中Fe3+沉淀完全时,Mg 2+ 是否开始沉淀 ,Mg(OH)2开始沉淀时溶液的pH为________。
(2)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有 。
a.MgO b.Mg(OH)2 c.NH3·H2O d.MgSO4
(3)若在空气中加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出生成Mg(OH)Cl或MgO相关的化 学方程式 。
(4)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是 。
(5)电解熔融的MgCl2,阳极的电极反应式为: 。
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧 碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
| A.所得溶液中的c(H+)=1.0×10-13mol·L-1 |
| B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1 |
| C.所加的烧碱溶液pH=13.0 |
| D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1 |
研究难溶电解质的沉淀溶解平衡及在生产生活中应用意义重大。
(1)FeS沉淀废水中的Hg2+的反应式为:_________________;
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2 (s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)•c2(OH-)=2×10-20mol2•L-2;
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)•c2(OH-)=2×10-20mol2•L-2;
①某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于_____;
②要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液中OH-浓度为__________。
试题篮
()