t℃时,水的离子积为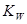 ,该温度下将a mol?L-1一元酸HA与b mol?L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
,该温度下将a mol?L-1一元酸HA与b mol?L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
| A.混合液的pH=7 | B.混合液中c(H+)=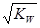 |
| C.a=b | D.混合液中c(B+)=c(A-)+c(OH-) |
将足量BaCO3粉末分别加入下列溶液中充分溶解至饱和。各溶液中Ba2+的浓度最小的为
| A.10 mL 0.2 mol/LNa2CO3溶液 | B.40 mL水 |
| C.50 mL 0.01 mol/L 氯化钡溶液 | D.100 mL 0.01 mol/L盐酸 |
已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18mol2·L-2;CuS:Ksp=1.3×
10-36mol2·L-2。 下列说法正确的是
| A.同温度下,CuS的溶解度大于FeS的溶解度 |
| B.同温度下,向饱和FeS溶液中呈入少量Na2S固体后,Ksp(FeS)变小 |
| C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现 的沉淀是FeS |
| D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
水的电离平衡为H2O 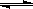 H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |
某温度下,水的离子积常数K 。该温度下,将pH=4的
。该温度下,将pH=4的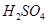 溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
| A.1∶10 | B.9∶1 | C.1∶9 | D.99∶21 |
下列说法中,正确的是
| A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 |
| B.Ksp越小,难溶电解质在水中的溶解能力一定越弱 |
| C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关 |
| D.相同温度下, AgCl在水中的溶解能力与在NaCl溶液中的相同 |
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-13mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1
C.镁铝合金5.1g溶于300mL2mol/LHCl溶液时,在标准状况下产生气体5.6L。若向反应后的溶液中加入过量烧碱溶液,则产生沉淀的质量为A.5.8gB.7.8gC.10.4gD.13.6g加的烧碱溶液pH=13.0
D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
下列各项中的两个量,其比例为2:1的是( )
| A.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 |
| B.同温度下,0.2mol/LCH3COOH溶液与0.1mol/L CH3COOH溶液中的c(H+)之比 |
| C.液面在“0”刻度,50mL酸式滴定管和25mL酸式滴定管内所盛溶液的体积 |
| D.0.2mol/L的NaHSO3溶液中的阳离子与阴离子的浓度之比 |
 一元弱酸HA(aq)中存在下列电离平衡:HA
一元弱酸HA(aq)中存在下列电离平衡:HA H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是( )
①有晶体析出 ②c(Ca(OH)2)增大 ③pH不变
④c(H+)·c(OH-)的乘积不变 ⑤c(H+)一定增大
| A.① | B.①③ | C.①②④ | D.①⑤ |
将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为:
| A.40mL 水 | B.10mL 0.2mol/LNa2CO3溶液 |
| C.50mL 0.01mol/L 氯化钡溶液 | D.100mL 0.01mol/L盐酸 |
在盛有饱和Ca(OH)2溶液的烧怀中,加入少量CaO粉末,充分作用后,恢复到原温度,下列说法正确的是( )
①有晶体析出 ②Ca(OH)2浓度增大 ③pH不变 ④c(H+)c(OH-)的积不变 ⑤c(OH-)一定增大
| A.① | B.①②③ | C.①⑤ | D.①③④ |
已知部分化合物的溶度积常数见下表:
| 化学式 |
Ksp |
化学式 |
Ksp |
| AgBr |
5.0×10-13 |
Ag2CO3 |
8.1×10-12 |
| Ag3PO4 |
1.4×10-16 |
CaCO3 |
2.8×10-9 |
| AgOH |
2.0×10-8 |
Ca3(PO4)2 |
2.0×10-29 |
现有某种KNO3溶液,其中混有少量KBr和Ca(H2PO4)2杂质,可供选择的试剂有:①AgNO3,②K2CO3,③KOH,④HNO3。若规定不得重复使用试剂,且最后溶液中只允许含有K+、NO3-和少量H+、OH-,则加入试剂顺序正确的是
| A.③①②④ | B.①③②④ | C.②①③④ | D.①②③④ |
已知25℃时,AgⅠ饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.30×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是
| A.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的KSP的数值为1.69×10-10 |
| D.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol·L-1。若在5mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8mL
0.01 mol·L-1AgNO3溶液,下列叙述正确是( )
| A.混合溶液中c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-) |
| B.混合溶液中c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-) |
| C.加入AgNO3溶液时首先生成AgCl沉淀 |
D.混合溶液中 约为1.02×103 约为1.02×103 |
试题篮
()