已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010 mol/L,向该溶液中逐滴加入0.010 mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
| A.Cl-、Br-、CrO42- | B.CrO42-、Br、Cl- |
| C.Br-、Cl-、CrO42- | D.Br、CrO42-、Cl- |
已知某温度下CH3COOH和NH3•H2O 的电离常数相等,现向10mL浓度为0.1mol•L‾1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中下列说法正确的是
| A.水的电离程度始终增大 |
| B.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO‾) |
| C.c(CH3COOH)与c(CH3COO‾)之和始终保持不变 |
| D.c(NH4+)/c(NH3•H2O)先增大再减小 |
部分弱电解质的电离平衡常数如下表:
| 弱电解质 |
HCOOH |
HCN |
H2CO3 |
NH3·H2O |
| 电离平衡常数 (25 ℃) |
Ka=1.8×10-4 |
Ka=4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
Kb=1.8×10-5 |
下列说法不正确的是
A.结合H+的能力:CO32->CN->HCO3->HCOO-
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.25 ℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水)
D.HCN + HCOONa = NaCN + HCOOH
在含有Fe3+、Fe2+、Al3+、Cl-的稀溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
| A.Al3+ 、Cl- | B.Al3+ | C.Fe2+、Cl- | D.Fe3+ |
现有含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH溶液的物质的量与生成沉淀的物质的量的关系正确的是(离子形成沉淀或沉淀的溶解与溶液pH的关系如下表)
| 离子 |
Mg2+ |
Al3+ |
物质 |
Al(OH)3 |
| 开始沉淀时的pH |
8.93 |
3.56 |
开始溶解时的pH |
8.04 |
| 完全沉淀时的pH |
10.92 |
4.89 |
完全溶解时的pH |
12.04 |

在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是
| A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等 |
| B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液 由Y点变为X点 |
| C.T ℃时,Ag2CrO4的Ksp为1×10-8 |
D.图中a=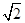 ×10-4 ×10-4 |
下列对沉淀溶解平衡的描述正确的是
| A.反应开始时溶液中个离子浓度相等 |
| B.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 |
| D.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
下列叙述正确的是
| A.常温下,pH值等于14与pH值等于12的两种NaOH溶液等体积混和后,c(H+)=(10-14+10-10)/2 |
| B.常温下,浓度为1×10-10mol/L的KOH溶液的pH值最接近于4 |
| C.氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 |
| D.常温下,相同温度下pH值等于1的盐酸溶液中水的电离程度与pH值等于13的Ba(OH)2溶液中水的电离程度相等 |
下列关于沉淀溶解平衡的说法中不正确的是( )
| A.难溶电解质在溶液中存在沉淀溶解平衡,且是一种动态平衡 |
| B.Ksp只与难溶电解质的性质与温度有关,而与沉淀的量和溶液中离子的浓度无关 |
| C.Ksp反映了物质在水中的溶解能力,可直接根据Ksp的大小比较电解质在水中溶解能力的大小 |
| D.可通过Q和Ksp的相对大小,来判断沉淀溶解平衡的移动方向 |
在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是
Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是
| A.加MgCl2 | B.加H2O | C.加NaOH | D.加HCl |
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如下图所示。据图分析,下列判断不正确的是
| A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
| B.加适量NH4 Cl固体可使溶液由a点变到b点 |
| C.c、d两点代表的溶液中c(H+ )与c(OH-)乘积相等 |
| D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 |
常见的无机酸25℃时在水溶液中的电离平衡常数如下表,下列选项正确的是
| 氢氰酸(HCN) |
碳酸(H2CO3) |
氢氟酸(HF) |
| K = 6.2×10-10 |
Ka1= 4.2×10-7 |
K=6.61×10-4 |
A.氟化钠溶液中通入CO2:2F-+H2O+CO2=2HF+CO32-
B.NaCN与HCN的混合溶液中:2c(Na+) = c(CN-)+ c(HCN)
C.0.2mol•L-1HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液的pH>7
D.25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者
在恒容密闭容器中存在下列平衡: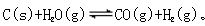 CO 的平衡物质的量浓
CO 的平衡物质的量浓
度与温度 T的关系如右图所示。下列说法错误的是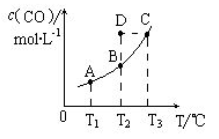
| A.该反应的ΔH >0 |
| B.若T1、T2时的平衡常数分别为K1、K2,则K1= K2 |
| C.通过加热可以使B点变到C点 |
| D.在T2 时若反应进行到状态D,则一定有υ(正) <υ(逆) |
下列物质的水溶液:①NaOH、②CH3COOH、③NH3,④NaHCO3、⑤Cl2,不能溶解CaCO3的是
| A.①③④ | B.①④⑤ | C.②④ | D.②⑤ |
下列叙述正确的是
| A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7] |
| C.25℃时,0. 1mo1·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
| D.0.1 mol AgCl和0. lmo1 AgI混合后加入1L水中所得溶液c(Cl-)=c(I-) |
试题篮
()