把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是
Ca2++2OH-下列说法正确的是
| A.恒温下向溶液中加CaO,溶液的pH升高 |
| B.给溶液加热,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,其中固体质量增加 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
下列说法不正确的是( )
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
下列说法错误的是
| A.一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的 △H>0 △S>0 |
| B.铅蓄电池放电时的负极和充电时的正极均发生氧化反应 |
| C.氯化镁溶液加热蒸干得不到纯净氯化镁固体 |
D.常温下,向饱和 溶液中加少量 溶液中加少量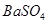 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)>Ksp(BaSO4) 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)>Ksp(BaSO4) |
化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
| A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
| B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强 |
| C.向硝酸银溶液中加入同浓度的氯化钠和溴化钠溶液,先产生浅黄色沉淀,则Ksp(AgBr)>Ksp(AgCl) |
| D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大 |
25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为(忽略溶液体积变化)
| A.1.8×10-7mol/L | B.1.8×10-8 mol/L |
| C.1.8×10-9mol/L | D.1.8×10-10mol/L |
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
| A.相同条件下,MnS的Ksp比CuS的Ksp大 |
B.该反应的平衡常数K= |
| C.该反应达到平衡时c(Mn2+)=c(Cu2+) |
| D.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中, AgCl能转化为AgI |
下列说法不正确的是
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.两种难溶电解质,Ksp小的,溶解度一定小 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.由于Ksp(ZnS) ﹥Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
室温下,有关叙述正确的是
| A.某物质的溶液pH <7,则该物质一定是酸或强酸弱碱盐 |
| B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)> c(CH3COO-) |
常温下,在BaSO4饱和溶液中加入Na2SO4固体,达到溶解平衡时,下列说法正确的是
| A.c(Ba2+)=c(SO42-) |
| B.c(Ba2+)增大,c(SO42-)减小 |
| C.c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)=Ksp(BaSO4) |
| D.c(Ba2+)≠c(SO),c(Ba2+)· c(SO42-)≠Ksp(BaSO4) |
将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
| A.只有AgBr沉淀生成 |
| B.AgCl和AgBr沉淀等量生成 |
| C.AgCl沉淀少于AgBr沉淀 |
| D.AgCl沉淀多于AgBr沉淀 |
当Mg(OH)2在水中达到溶解平衡时:Mg(OH)2(s)⇌Mg2+(aq)+2OH﹣(aq)要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是
| A.NH4Cl | B.NaOH | C.Na2CO3 | D.Fe |
在含有浓度均为0.01mol•L-1的Cl-、Br-、I-离子的溶液中,缓慢加入AgNO3稀溶液,析出三种沉淀的先后顺序是
| A.AgCl、AgBr、AgI | B.AgI、AgBr、AgCl |
| C.AgBr、AgCl、AgI | D.三种沉淀同时析出 |
试题篮
()