已知:25°C时,Ksp﹝Mg(OH)2﹞=5.61×10-12,Ksp﹝MgF2﹞=7.42×10-11。下列说法正确的是
| A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25°C时,Mg(OH)2固体在20 ml 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的小 |
| C.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
| D.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是
| A.AgCl的悬浊液中通入少量HCl,c(Ag+)减小 |
| B.AgCl和AgBr共存的悬浊液中,c(Cl-)/c(Br-)=360 |
| C.AgBr悬浊液中加入足量NaCl可能有AgCl沉淀生成 |
| D.等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀 |
下列说法正确的是
| A.pH=2和pH=1的硝酸中c(H+)之比为1:10 |
B.Na2CO3溶液c(Na+)与c(CO )之比为2:1 )之比为2:1 |
| C.0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1 |
| D.pH=1的硫酸中加入等体积0.05 mol/L的BaCl2溶液,两者恰好反应C(SO42-)=0 |
下列说法中正确的是
| A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 |
| B.AgCl悬浊液中存在平衡:AgCl(s)⇌Ag+(aq)+Cl﹣(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C.硬水中含有较多的Ca2+、Mg2+、HCO3﹣、SO42﹣,加热煮沸可以完全除去其中的 Ca2+、Mg2+ |
| D.为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是
| A.加入Na2SO4可使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
下列由实验现象得出的结论正确的是
| |
操作及现象 |
结论 |
| A |
向AgCl悬浊液中加入NaI溶液时出现黄色沉淀。 |
Ksp(AgCl)< Ksp(AgI) |
| B |
向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。 |
溶液中一定含有Fe2+ |
| C |
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色。 |
Br—还原性强于Cl— |
| D |
加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结。 |
NH4Cl固体可以升华 |
已知常温下Ksp(AgCl)=1.8×l0-10,Ksp(AgBr)=5×10 -13,下列有关说法错误的是
A.在饱和AgCl、AgBr的混合溶液中: = 360 = 360 |
| B.向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀 |
| C.AgCl在水中溶解度及Ksp均比在NaCl溶液中的大 |
| D.欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol/L |
某温度时,AgCl(s)  Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
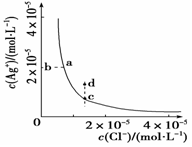
| A.加入AgNO3,可以使溶液由c点变到d点 |
| B.加入少量水,平衡右移,Cl-浓度减小 |
| C.d点没有AgCl沉淀生成 |
| D.c点对应的Ksp等于a点对应的Ksp |
已知:25℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11。下列判断正确的是
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体, c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20mL0.01mol/L氨水中的Ksp比在20mL0.01mol/LNH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后Mg(OH)2不可能转化为MgF2 |
下列说法正确的是
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)的ΔH<0 |
| B.常温下,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 |
| C.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| D.等体积、等物质的量浓度的NH3·H2O溶液与NH4Cl溶液混合后溶液呈碱性,说明NH3·H2O的电离程度小于NH4+的水解程度 |
下列依据相关实验得出的结论正确的是
| A.在硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) |
| B.测得Na2CO3溶液的pH大于同浓度的Na2SO3溶液,说明非金属性C<S |
| C.用激光笔分别照射蛋清溶液和葡萄糖溶液,能产生光亮“通路”的是蛋清溶液 |
| D.在淀粉溶液中加入稀硫酸并加热片刻再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 |

 已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中, Ag+浓度大小顺序正确的是
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中, Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgCl> AgBr>AgI |
| C.AgBr >AgCl>AgI | D.AgBr >AgI>AgCl |
Mg(OH)2固体在水中存在下列溶解平衡:Mg(OH)2(s)  Mg2+(aq)+2OH-(aq),欲减少Mg(OH)2固体的量,可以加入少量的
Mg2+(aq)+2OH-(aq),欲减少Mg(OH)2固体的量,可以加入少量的
| A.NaOH固体 | B.NaCl固体 |
| C.MgSO4固体 | D.NaHSO4固体 |
试题篮
()