实验:①0.1 mol·L-1 AgNO3溶液和0.1 mol·L-1 NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 mol·L-1 KI溶液,出现浑浊;③向沉淀c中滴加0.1 mol·L-1 KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
已知25 ℃物质的溶度积常数为:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24。下列说法正确的是
| A.相同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
| C.足量CuSO4溶解在0.1 mol/L的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol/L |
| D.在ZnS的饱和溶液中,加入FeCl2溶液,一定不产生FeS沉淀 |
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量m(沉淀)与加入AgNO3溶液体积V(AgNO3)的关系如图所示。则原溶液中c(I-)/c(Cl-)的比值为
| A.(V2-V1)/V1 | B.V1/V2 | C.V1/(V2-V1) | D.V2/V1 |
已知室温下,Al(OH)3的溶解度远大于Fe(OH)3。向浓度均为0.1mol·L—1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
| C.向反应后的溶液加入乙醇,溶液没有发生变化 |
| D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lgc(M),p(CO32﹣)=﹣lgc(CO32﹣).下列说法正确的是
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a 点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32﹣) |
| C.b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32﹣) |
| D.c 点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32﹣) |
已知:在一定温度下,微溶电解质Ca(OH)2在饱和溶液中建立沉淀—溶解平衡:Ca(OH)2(s)  Ca2+(aq)+2OH-(aq),溶度积常数Ksp=c(Ca2+)c(OH-)2.下列有关说法不正确的是
Ca2+(aq)+2OH-(aq),溶度积常数Ksp=c(Ca2+)c(OH-)2.下列有关说法不正确的是
| A.饱和石灰水中加入生石灰,若保持温度不变,则溶液中Ca2+的物质的量不变 |
| B.升高饱和石灰水的温度时,Ca(OH)2溶度积常数Ksp减小 |
| C.饱和石灰水中加入生石灰,若保持温度不变,则pH不变 |
| D.向饱和石灰水中加入浓CaCl2溶液会有Ca(OH)2沉淀析出 |
下列说法正确的是
A.浓度为0.1mol·L-1 CH3COOH溶液,加水稀释,则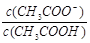 减小 减小 |
| B.浓度为0.1mol·L-1 CH3COOH溶液,升高温度,Ka (CH3COOH)不变,但醋酸的电离程度增大 |
| C.在稀AgNO3溶液中先加入过量0.1mol/L NaCl溶液,再加入少量0.1mol/L Na2S溶液,先产生白色沉淀,后出现黑色沉淀,说明Ksp(AgCl)>Ksp(Ag2S) |
D.在恒容密闭容器中,反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H<0达到平衡后,使用高效催化剂,正反应速率增加,逆反应速率减小,平衡正向移动 CH3OH(g)+H2O(g)△H<0达到平衡后,使用高效催化剂,正反应速率增加,逆反应速率减小,平衡正向移动 |
下列说法正确的是
| A.反应CaCO3(s)=CaO(s)+CO2(g)在常温下不能发生,则该反应的△H>0 |
B.0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中 的值减小 的值减小 |
| C.铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除 |
已知:25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11。下列说法正确的是
| A.25℃时,在CaCO3悬浊液中加入NaF固体,CaCO3全部溶解 |
| B.25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,前者Ca2+浓度大 |
| C.25℃时,CaCO3固体在盐酸中的Ksp比在氨水中的Ksp大 |
| D.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,不会析出CaF2固体 |
已知常温下Ksp(AgCl)=1.8×l0-10,Ksp(AgBr)=5×10 -13,下列有关说法错误的是
A.在饱和AgCl、AgBr的混合溶液中: = 360 = 360 |
| B.向AgCl悬浊液中滴加浓NaBr溶液会产生淡黄色沉淀 |
| C.AgCl在水中溶解度及Ksp均比在NaCl溶液中的大 |
| D.欲用1 L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)≥3.61 mol/L |
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
| A.CuS的溶解度大于PbS的溶解度 |
| B.原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C.CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ |
| D.整个过程涉及的反应类型有氧化还原反应和复分解反应 |
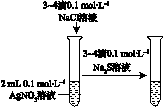
下图所示的实验,能达到实验目的的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 验证化学能 转化为电能 |
证明温度 对平衡移动的影响 |
验证铁钉 发生析氢腐蚀 |
验证AgCl 溶解度大于Ag2S |
下列说法正确的是
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)的ΔH<0 |
| B.常温下,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 |
| C.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| D.等体积、等物质的量浓度的NH3·H2O溶液与NH4Cl溶液混合后溶液呈碱性,说明NH3·H2O的电离程度小于NH的水解程度 |
试题篮
()