下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液 |
溶液变成红色 |
Fe(NO3)2试样已变质 |
| B |
将少量某无色气体通入澄清石灰水 |
出现白色沉淀 |
该气体一定是CO2 |
| C |
分别测定常温下0.1 mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH |
pH:Na2SiO3> Na2CO3 |
非金属性:Si>C |
| D |
向浓度均为0.1 mol·L-1 NaCl和NaI混合溶液中,滴加少量AgNO3溶液 |
出现黄色沉淀 |
Ksp(AgCl)>Ksp(AgI) |
向AgCl饱和溶液中加水,下列叙述正确的是 ( )
| A.溶解度.Ksp均不变 | B.溶解度.Ksp均变大 |
| C.结晶过程停止,溶解过程加快 | D.结晶过程将小于溶解过程,直至再达到平衡 |
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,再用酸除去。下列说法不正确的是
| A.CaCO3的溶解度小于CaSO4 |
| B.沉淀转化的实质是沉淀溶解平衡的移动 |
| C.沉淀转化的难易与溶解度差别的大小无关 |
| D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡 |
已知一定量Ca(OH)2固体溶于水后,存在以下平衡状态:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),Ksp=4.7×10-6 mol3/L3,下列措施可使Ksp增大的是( )
Ca2+(aq)+2OH-(aq),Ksp=4.7×10-6 mol3/L3,下列措施可使Ksp增大的是( )
| A.升高温度 | B.降低温度 |
| C.加入适量CaO固体 | D.加入适量Na2CO3固体 |
下列叙述正确的是
| A.Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显碱性 |
| D.常温下,在Fe(OH)3悬浊液中加入足量MgCl2溶液,沉淀由红褐色转化为白色 |
25℃时,在含有大量的PbI2饱和溶液中存在平衡:PbI2(s) Pb2+(aq)+2I-(aq),向其中加入KI固体,下列说法正确的是 ( )
Pb2+(aq)+2I-(aq),向其中加入KI固体,下列说法正确的是 ( )
| A.溶液中Pb2+和I-浓度都增大 | B.溶度积常数Ksp增大 |
| C.沉淀溶解平衡向逆向移动 | D.PbI2的溶解度不变 |
用
滴定
溶液的滴定曲线如图所示。下列有关描述错误的是( )

| A. | 根据曲线数据计算可知 的数量级为 |
B. | 曲线上各点的溶液满足关系式 |
| C. | 相同实验条件下,若改为 , 反应终点c移到a |
D. | 相同实验条件下,若改为 , 反应终点c向b方向移动 |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(AgBr)=7.7×10-13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgBr >AgI>AgCl |
| C.AgBr >AgCl>AgI | D.AgCl> AgBr>AgI |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是( )
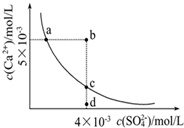
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
| A.2句 | B.3句 | C.4句 | D.5句 |
饱和石灰水中存在溶解平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
Ca2+(aq)+2OH-(aq),向其中加入少量生石灰,充分反应后恢复至原温度,则下列说法中不正确的是( )
| A.溶液的pH不变 | B.溶液中Ca2+的浓度减小 |
| C.溶液中OH-的数目减小 | D.容器中固体的质量增加 |
下列实验对应的现象及结论均正确且两者具有因果关系的是
| 选项 |
实验 |
现象 |
结论 |
| A |
SO2通入BaCl2溶液,然后滴入稀硝酸 |
白色沉淀,白色沉淀不溶于稀硝酸 |
所得沉淀为BaSO3,后转化为BaSO4 |
| B |
浓硫酸滴入蔗糖中,并搅拌 |
得黑色蓬松的固体并有刺激性气味气体 |
该过程中浓硫酸仅体现吸水性和脱水性 |
| C |
向FeCl2溶液中加入足量Na2O2粉末 |
出现红褐色沉淀和无色气体 |
FeCl2溶液部分变质 |
| D |
向足量含淀粉的FeI2溶液中滴加2滴氯水 |
溶液变蓝 |
还原性:I->Fe2+ |
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
已知:在一定温度下,微溶电解质Ca(OH)2在饱和溶液中建立沉淀—溶解平衡:Ca(OH)2(s)  Ca2+(aq)+2OH-(aq),溶度积常数Ksp=c(Ca2+)c(OH-)2.下列有关说法不正确的是
Ca2+(aq)+2OH-(aq),溶度积常数Ksp=c(Ca2+)c(OH-)2.下列有关说法不正确的是
| A.饱和石灰水中加入生石灰,若保持温度不变,则溶液中Ca2+的物质的量不变 |
| B.升高饱和石灰水的温度时,Ca(OH)2溶度积常数Ksp减小 |
| C.饱和石灰水中加入生石灰,若保持温度不变,则pH不变 |
| D.向饱和石灰水中加入浓CaCl2溶液会有Ca(OH)2沉淀析出 |
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是
| 选项 |
规律 |
结论 |
| A |
较强酸可以制取较弱酸 |
用亚硫酸溶液无法制取硫酸溶液 |
| B |
升高温度,反应速率越快 |
常温下钠与氧气反应生成氧化钠,升高温度,Na2O的生成速率加快 |
| C |
金属越活泼,其阳离子氧化性越弱 |
Fe3+的氧化性弱于Cu2+ |
| D |
Ksp小的沉淀易向Ksp更小的沉淀转化 |
CaSO4悬浊液中滴加Na2CO3溶液可生成CaCO3沉淀 |
在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀。最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
| |
AgCl |
AgI |
Ag2S |
| Ksp |
1.8×10-10 |
8.51×10-16 |
6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
试题篮
()