 一元弱酸HA(aq)中存在下列电离平衡:HA
一元弱酸HA(aq)中存在下列电离平衡:HA H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是( )
①有晶体析出 ②c(Ca(OH)2)增大 ③pH不变
④c(H+)·c(OH-)的乘积不变 ⑤c(H+)一定增大
| A.① | B.①③ | C.①②④ | D.①⑤ |
将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为:
| A.40mL 水 | B.10mL 0.2mol/LNa2CO3溶液 |
| C.50mL 0.01mol/L 氯化钡溶液 | D.100mL 0.01mol/L盐酸 |
在盛有饱和Ca(OH)2溶液的烧怀中,加入少量CaO粉末,充分作用后,恢复到原温度,下列说法正确的是( )
①有晶体析出 ②Ca(OH)2浓度增大 ③pH不变 ④c(H+)c(OH-)的积不变 ⑤c(OH-)一定增大
| A.① | B.①②③ | C.①⑤ | D.①③④ |
已知部分化合物的溶度积常数见下表:
| 化学式 |
Ksp |
化学式 |
Ksp |
| AgBr |
5.0×10-13 |
Ag2CO3 |
8.1×10-12 |
| Ag3PO4 |
1.4×10-16 |
CaCO3 |
2.8×10-9 |
| AgOH |
2.0×10-8 |
Ca3(PO4)2 |
2.0×10-29 |
现有某种KNO3溶液,其中混有少量KBr和Ca(H2PO4)2杂质,可供选择的试剂有:①AgNO3,②K2CO3,③KOH,④HNO3。若规定不得重复使用试剂,且最后溶液中只允许含有K+、NO3-和少量H+、OH-,则加入试剂顺序正确的是
| A.③①②④ | B.①③②④ | C.②①③④ | D.①②③④ |
已知25℃时,AgⅠ饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.30×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是
| A.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的KSP的数值为1.69×10-10 |
| D.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol·L-1。若在5mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8mL
0.01 mol·L-1AgNO3溶液,下列叙述正确是( )
| A.混合溶液中c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-) |
| B.混合溶液中c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-) |
| C.加入AgNO3溶液时首先生成AgCl沉淀 |
D.混合溶液中 约为1.02×103 约为1.02×103 |
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
| A.所得溶液中的c(H+)=1.0×10-13 mol·L-1 |
| B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1 |
| C.所加的烧碱溶液pH=13.0 |
| D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1 |
在一混合溶液中含有KCl、KBr、K2CrO4,其浓度均为0.01 mol·L-1,向溶液中逐滴加入0.01 mol·L-1AgNO3溶液时,最先和最后沉淀的物质是( )
(AgCl、 AgBr、 Ag2CrO4的Ksp分别为1.77×10-10、5.35×10-13、1.12×10-12)
| A.AgBr、AgCl | B.Ag2CrO4、AgCl |
| C.AgBr、Ag2CrO4 | D.同时沉淀 |
已知:,
,
,则下列难溶盐的饱和溶液中,
浓度大小顺序正确的是()
| A. |
|
B. |
|
| C. |
|
D. |
|
向盛有0.1mol/LAgNO3溶液的试管中滴加0.1mol/LNa2S溶液至沉淀完全,再向上层清液中滴加足量NaCl溶液,产生的现象或生成的物质是( )
| A.黑色沉淀完全转化为白色沉淀 | B.既有氯化银也有硫化银 |
| C.不能由黑色沉淀转化为白色沉淀 | D.只有氯化银白色沉淀 |
某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是:
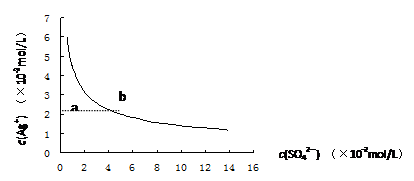 |
| A.含有大量SO42-的溶液中肯定不存在Ag+ |
| B.Ag2SO4的溶度积常数(Ksp)为1×10-4 |
| C.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀 |
| D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是 ( )
A.Mg2++ +2Ca2++4OH- +2Ca2++4OH- Mg(OH)2↓+2CaCO3↓+2H2O Mg(OH)2↓+2CaCO3↓+2H2O |
B.Cu2++H2S CuS↓+2H+ CuS↓+2H+ |
C.Zn2++S2-+2H2O Zn(OH)2↓+H2S↑ Zn(OH)2↓+H2S↑ |
D.FeS+2H+ Fe2++H2 S↑ Fe2++H2 S↑ |
工业制氯化铜时,是将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌使之溶解,反应如下:CuO+2HCl====CuCl2+H2O,FeO+2HCl====FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀,pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
为除去溶液中的Fe2+,可以采用的方法是( )
| A.直接加碱,调整溶液pH≥9.6 |
| B.加纯铜粉,将Fe2+还原出来 |
| C.通入适量Cl2,再加碱调整溶液的pH为4 |
| D.直接加铁粉将Cu2+还原出来 |
试题篮
()