能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g)=H2O(l) ΔH=-44.0 kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
①该电池负极的电极反应为 。
②工作一段时间后,测得溶液的pH (填增大、不变、减小)。
③用该电池作电源,组成如下图所示装置(a、b、c、d均为石墨电极),甲容器装250mL0.04mol/LCuSO4溶液,乙容器装300mL饱和NaCl溶液,写出c电极的电极反应 ,常温下,当300mL乙溶液的pH为13时,断开电源,则在甲醇电池中消耗O2的体积为 mL(标准状况),电解后向甲中加入适量下列某一种物质,可以使溶液恢复到原来状态,该物质是 (填写编号) 。
| A.CuO | B.CuCO3 | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
| 元素 |
原子结构或性质 |
| A |
原子最外层电子数是内层电子总数的1/5 |
| B |
形成化合物种类最多的元素,其单质为固体 |
| C |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D |
地壳中含量最多的元素 |
| E |
与D同主族 |
| F |
与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是__________;用电子式表示A和E形成的化合物的形成过程 。
(2)A、 D 、E、 F离子半径由大到小的顺序为________________________________。
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是__________________;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是____________________。该反应为 反应。(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为 。
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为 ;外电路中电子从 电极流向 电极 。
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
Ⅰ.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙
乙+丙
b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则甲发生a反应的化学方程式为: ;
②若甲为某短周期金属元素的氯化物,则该金属在周期表中的位置是: ;
若向30 mL 1 mol/L的甲的溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 (选填编号).
| A.3 mL | B.7.5 mL | C.15 mL | D.27.5 mL |
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为 。
Ⅱ.若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①写出上述反应的化学方程式 。
②0.5 mol气体甲与足量的过氧化钠反应,转移电子的数目为 。
③将一定量气体甲通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(甲)的关系如图所示,溶液A中各离子浓度由大到小的顺序为 。

(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。

②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。

①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1molCuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)氮氧化物产生的环境问题有 (填一种)。
(2)氧化—还原法消除氮氧化物的转化如下:
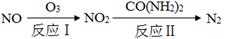
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
①已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
写出NO和O2反应生成NO2的热化学方程式 。
②一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3∶1,则NO2的平衡转化率是 。
③上述反应达平衡后,其它条件不变时,再往容器中同时充入
NO2、SO2、SO3、NO各1mol,平衡 (填序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料。则负极的电极反应式是 。
(15分)卤素的单质及其化合物在生产、生活中应用广泛。
(1)“碘盐"通常是在食盐中添加适量的K1O3,为缺碘地区人们提供碘元素。
①碘元素的一种原子含74个中子、5 3个质子,表示此核素的符号是___(如 )。
)。
②“碘盐"溶液用稀硫酸酸化后,再加入淀粉碘化钾溶液,溶液由无色变篮色。
写出该反应的化学方程式__________________________________________。
③碘单质溶解在有机溶剂___________中形成常用的医用消毒剂(填结构简式)。
(2)工业上利用氢气和氯气反应制取盐酸,设计成原电池又能获取电能,下列说法错误的是___(填选项)。
| A.两极材料可用石墨,用稀盐酸做电解质溶液 |
B.通氯气的电极反应式为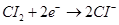 |
| C.电解质溶液中的阳离子向通氯气的电极移动‘ |
| D.通入氢气的电极为原电池的正极 |
(3)H2和卤素单质(F2、C12、Br2、12)反应生成I molHX的能量变化如图所示(反应物和产物均为298K时的稳定状态)。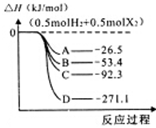
①曲线A代表的卤化氢是__________(填化学式)。
②写出Br2(1)与HCI气体反应的热化学方程式___________。
③往甲乙两容器分别通入等量的H2和I2,两容器起始状态相同,甲为恒容绝热密闭容器,乙为恒容恒温密闭容器,发生反应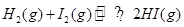 ,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。
,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。
【改编】SO2、NOx、CO2是对环境影响较大的气体,控制和治理SO2、NOx、CO2是减少酸雨、光化学烟雾和解决温室效应的有效途径。
(1)碳元素在元素周期表的位置: 。
(2)标况下2.24LSO2恰好被1L 0.2mol·L-1的NaOH溶液完全吸收,请写出吸收后溶液中离子浓度由大到小的顺序为 。
(3)已知汽车尾气NO与CO净化反应生成无污染气体,3g NO参加该反应放出37.99 kJ热量,请写出该反应的热化学方程式: 。
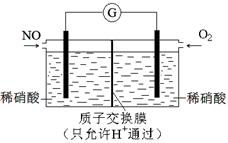
(4)某科研小组想以如图所示装置用原电池将 SO2转化为重要的化工原料。
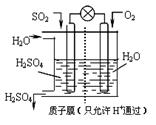
①其负极反应式: ,
②当有1mol SO2被吸收,则通过质子(H+)交换膜的H+离子数为 。
(5)某科研小组用CO2通过下面反应方程式来生产甲醇,
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH= —49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH= —49.0kJ·mol-1
现将6molCO2和8molH2充入一容积为2L的恒温密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。
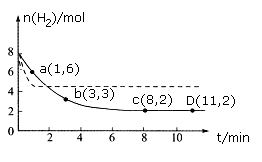
回答下列问题:
①此温度下该反应的平衡常数的数值K= 。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线改变的条件可能是 。
(14分)请回答下列问题:
(1)下表列出了一些化学键的键能E:
| 化学键 |
H—H |
O===O |
O—H |
| E/kJ·mol-1 |
436 |
x |
463 |
反应H2(g)+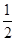 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
(2)铅蓄电池是正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液,电池放电时的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请写出充电时阴极的电极反应式:__________________
(3)反应m A+n B p C,在某温度下达到平衡。
p C,在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向________________方向移动。
③若再升高温度,平衡向逆向移动,则正反应为 _________ 反应(填“吸热”或“放热”)
(4)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。

①请在图中标出电极材料及电解质溶液(写化学式)________________
②盐桥中的Cl-向________极移动(填“左”或“右”)。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请完成以下问题: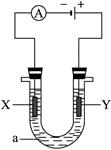
(1)若X、Y者是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中化学反应方程式为_____________,在X极附近观察到的现象是_________________。
②检验Y电极上反应产物的方法是_________________________。
③当导线中有0.1 mol的电子通过时,在标况下理论上两极可收集的气体的体积是__ __L。
(2)下图装置中,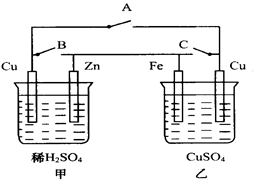
①当A键断开,B、C闭合时,乙为 池;
②当A、C两键断开, B闭合时,乙中铁极增重1.6g,则被氧化的铁有 g;
③将乙中两极都换成石墨,硫酸铜溶液换H2SO4后断开B、C两键, 闭合A键,则乙为 池,当甲中锌极减轻6.5g时,乙中共放出气体 mL(标况)。
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:
2Mn2++5S2O82-+8H2O  2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的价电子排布式为 。
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为 (填元素符号)。
(3)已知H2S2O8的结构如图。
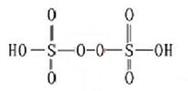
①H2S2O8硫原子的轨道杂化方式为 。
②上述反应中被还原的元素为 。
③上述反应每生成1 mol MnO4-,S2O82- 断裂的共价键类型及其数目为 、 。
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。

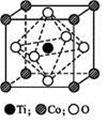
①右图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为 ;
②实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是 。
(5)MnO2可用于碱锰电池材料的正极材料,加入某种纳米粉体可以优化碱锰电池的性能,该纳米粉体的结构如右图。该纳米粉体的化学式为__________。
(6)铑(Rh)与钴属于同族元素,性质相似。铑的某配合物的化学式为CsRh(SO4)2·4H2O,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为 。
I.下图为相互串联的三个装置,试回答: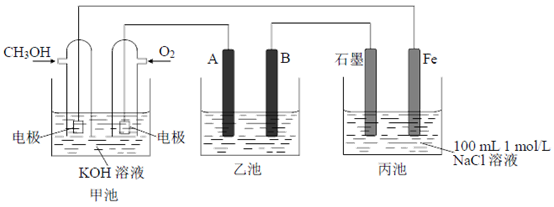
(1)若利用乙池在铁片上镀银,则B是_________(填电极材料),电极反应式是_________;应选用的电解质溶液是_____________。
(2)若利用乙池进行粗铜的电解精炼,则________极(填“A”或“B”)是粗铜,若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____________________。
(3)丙池滴入少量酚酞试液,电解一段时间___________(填“C”或“Fe”)极附近呈红色。
(4)写出甲池负极的电极反应式:________________________________。若甲池消耗3.2gCH3OH气体,则丙池中阳极上放出的气体物质的量为______________。
II.(5)请利用反应Fe +2Fe3+= 3Fe2+设计原电池。
设计要求:①该装置尽可能提高化学能转化为电能的效率;
②材料及电解质溶液自选,在图中做必要标注;
③画出电子的转移方向。
Ⅰ.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
(1)推断B元素在元素周期表中的位置_______________________。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为_____________。
(3)用电子式表示化合物E2F的形成过程_______________________。
(4)下图为某新型发电装置示意图,其负极电极反应为_______________________。

(5)在101kPa、25℃下,16g液态C2A4在D2中完全燃烧生成气体C2,放出312kJ热量,则C2A4和D2反应的热化学方程式为_______________________。
Ⅱ.A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。
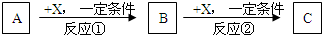
试回答:
(1)若X是强氧化性单质,则A不可能是___________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的 化 学式为___________。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为___________。
金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值:
(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
美国斯坦福大学研究人员最近发明一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电。海水中的“水”电池总反应可表示为:5MnO2 + 2Ag + 2NaCl=Na2Mn5O10 + 2AgCl
(1)写出负极电极反应式 。
(2)当生1 mol Na2Mn5O10时,转移电子的数目是 。
用上述电池电解尿素[CO(NH2)2]的碱性溶液制合成氨的装置如图(隔膜仅阻止气体通过,阴、阳极均为惰性电极)。

(3)写出A电极的名称 。
(4)写出电解时阳极的电极反应式 。
(5)已知电解排出液中n(OH-)/n(CO32-) =1,则起始时进入电解池中的原料配比n(KOH)/n[CO(NH2)2]是 。
(原创)化学反应原理在生产和科研中有着重要的应用,请利用相关知识回答下列问题。
(1)一定条件下在密闭容器中加入NH4I发生反应:
a.NH4I(s)  NH3(g)+HI(g)
NH3(g)+HI(g)
b.2HI(g)  H2(g)+I2(g)
H2(g)+I2(g)
则反应a的平衡常数表达式为_______;达到平衡后,扩大容器体积,反应b的移动方向_______(填正向、逆向或不移动)
(2)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2 N2O4△H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
N2O4△H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
| A.b点的操作是压缩注射器 |
| B.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc |
D.d点: (正)> (正)>  (逆) (逆) |
(3)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
①电极a为______极,其电极反应式为________________
②当有2.24 L NO2(标准状况下)被处理时,转移电子为____________mol
③为使电池持续放电,该离子交换膜需选用_______(选填“阳”或“阴”)离子交换膜。
(4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式______________________________。
②在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,为抑制肼的分解,可采取的合理措施有_________________________________ (任写一种)。
试题篮
()