原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Fe、Cu、NaCl溶液组成原电池,其负极反应式为:Cu - 2e-= Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗Cu电极32g |
利用下图装置可以模拟铁的电化学防护。下列说法不正确的是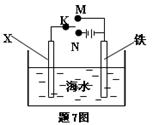
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀 |
| B.若X为锌棒,开关K置于M处,铁极发生氧化反应 |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀 |
| D.若X为碳棒,开关K置于N处,X极发生氧化反应 |
在常温常压下,某实验小组按下图做完实验后,实验报告记录如下。其中描述合理的是
| A.①②③ | B.②③④ | C.②⑤⑥ | D.③④⑥ |
如图所示,由锌片、铜片和稀硫酸溶液构成的原电池中,下列叙述正确的是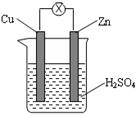
| A.锌片为负极,发生还原反应 |
| B.电流从锌片流向铜片 |
| C.一段时间后,铜片质量减轻 |
| D.一段时间后,溶液pH值变大 |
下列关于铜电极的叙述正确的是
| A.铜锌原电池中铜是负极 | B.用电解法精炼粗铜时粗铜作阴极 |
| C.在镀件上电镀铜时可用铜作阳极 | D.电解食盐水时铜作阳极 |
下列实验操作、现象和原因解释不合理的是
| 选项 |
实验操作 |
实验现象 |
原因解释 |
| A. |
将一片较簿的铝片放在酒精灯火焰上灼烧 |
铝片慢慢熔化呈液滴状 |
铝表面的氧化膜致密且熔点很高,阻碍铝与氧气的接触,同时铝的熔点较低熔化了 |
| B. |
将等表面积的镁条、铝片(均除去氧化膜)分别放入装有等浓度、等体积盐酸的两支试管中 |
都产生气泡,镁条表面产生气泡更快 |
镁的金属性比铝的金属性强,镁更易失去电子,所以反应更快 |
| C. |
在打磨过的铁片上先滴一滴饱和食盐水,再滴一滴酚酞 |
液滴的外圈先出现红色 |
铁片不纯含有碳元素,铁、碳与食盐水形成原电池,溶液外圈发生吸氧腐蚀,导致c(OH-)增大,溶液呈碱性 |
| D. |
取少量淀粉加稀硫酸,加热几分钟,冷却后加入新制氢氧化铜悬浊液,加热至沸腾 |
未见砖红色沉淀生成 |
淀粉水解后没有葡萄糖生成 |
在下图所示的柠檬电池中,外电路上的电子从电极Y流向电极X。若X为铁,则Y可能是
| A.锌 | B.石墨 | C.银 | D.铜 |
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是2Ag + 2H+ ="=" 2Ag+ + H2 ↑,则下列关于该装置的有关说法正确的是
| A.该装置可能是原电池,也可能是电解池 |
| B.该装置只能是原电池,且电解质溶液为硝酸 |
| C.该装置只能是电解池,且金属银为该电解池的阳极 |
| D.该装置只能是原电池,电解质溶液不可能是盐酸 |
下列关于铜电极的叙述正确的是
| A.铜锌原电池中铜是负极 |
| B.用电解法精炼精铜时粗铜作阴极 |
| C.在镀件上电镀铜时可用金属铜作阳极 |
| D.电解稀硫酸制H2、O2时铜作阳极 |
通过一个阶段的复习,你认为下列说法正确的是
| A.在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原 |
| B.在原电池装置中,一定要有两个活泼性不同的金属电极 |
| C.在化合物中,不是电解质就是非电解质 |
| D.对于可逆反应,温度升高则该反应的平衡常数一定增大 |
试题篮
()