高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
下列叙述不正确的是
| A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 |
| B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO42—+ 4H2O |
| C.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2 |
| D.放电时正极附近溶液的碱性增强 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充电一次。其电池反应为:2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列说法不正确的是 ( )
2CO32-+6H2O,则下列说法不正确的是 ( )
| A.充电时,电能转化为化学能 |
| B.充电时,电解质溶液的pH逐渐增大 |
| C.放电时,CH3OH参与反应的电极为负极,发生还原反应 |
| D.放电时,负极的电极反应为:CH3OH+8OH--6e-===CO32-+6H2O |
用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,该电池放电时的总反应为:CH4+2KOH+2O2==K2CO3+3H2O,下列说法错误的是( )
| A.通甲烷的一极为负极,通氧气的一极为正极 |
| B.放电时通入氧气的一极附近溶液的pH升高 |
| C.放电一段时间后,KOH的物质的量不发生变化 |
| D.通甲烷的电极反应式是:CH4+10OH --8e-==CO32-+7H2O |
已知反应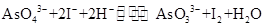 是可逆反应。设计如图装置(
是可逆反应。设计如图装置( 、
、 均为石墨电极),分别进行下述操作。
均为石墨电极),分别进行下述操作。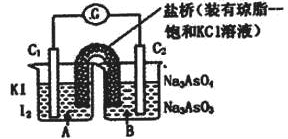
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转.据此,下列判断正确的是
| A.操作Ⅰ过程中,C1为正极 |
| B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 |
| C.Ⅰ操作过程中,C2棒上发生的反应为:AsO43-+2H++2e-=AsO33-+H2O |
| D.Ⅱ操作过程中,C1棒上发生的反应为:2I――2e-=I2 |
下列说法不正确的是( )
| A.充电电池充电时,发生电解池反应;放电时,发生原电池反应 |
| B.电镀时,应将镀层金属与电源正极相连 |
| C.电解饱和NaCl溶液时,阳极上放出黄绿色气体的同时还产生大量的氢氧化钠 |
| D.利用电化学原理保护金属主要有两种方法,分别是牺牲阳极的阴极保护法和外加电流的阴极保护法 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: ,下列叙述错误的是:
,下列叙述错误的是:
| A.放电时正极附近溶液的碱性增强 | B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C.充电时锌极与外电源负极相连 | D.充电时阳极反应为:Fe(OH)3— 3e-+ H2O |
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-=LiFePO4 负极 Li-e-= Li+ 下列说法中正确的是
| A.充电时电池反应为FePO4+Li = LiFePO4 |
| B.充电时动力电池上标注“+”的电极应与外接电源的正极相连 |
| C.放电时电池内部Li+向负极移动 |
| D.放电时,在正极上是Li+得电子发生氧化反应 |
【改编】如图所示的电化学装置,下列叙述正确的是
| A.a和b用导线连接,溶液中的Na+向铁电极移动 |
| B.a和b用导线连接,碳电极的电极反应为:O2+2H2O-4e-=4OH— |
| C.a、b分别连接直流电源正、负极,可以防止铁被腐蚀,属于牺牲阳极的阴极保护法 |
| D.若碳电极换成铜电极,氯化钠换成硫酸铜,a、b分别连接直流电源负、正极,可实现铁上镀铜 |
利用如图所示装置进行下列实验,下表中对应叙述正确的是
| A |
X为硫酸氢钠,Y为石墨 K与M连接时;K与N连接时 |
一段时间后溶液的pH均增大 |
| B |
X为氯化钠,Y为石墨 K与M连接时; K与N连接时 |
石墨电极反应均为: 4OH--4e-===2H2O+O2↑ |
| C |
X为硫酸氢钠,Y为锌 K与M连接时; K与N连接时 |
铁电极反应均为: 2H++2e-===H2↑ |
| D |
X为氯化钠,Y为锌 K与M连接时; K与N连接时 |
铁电极的保护方法均为: 牺牲阳极的阴极保护法 |
在如图所示装置中,观察到电流表指针偏转,M棒(左)变粗,N棒(右)变细,由此判断下表中所列M、N、P物质,其中可以成立的是
| |
M |
N |
P |
| A、 |
锌 |
铜 |
 稀硫酸溶液 稀硫酸溶液 |
| B、 |
铜 |
铁 |
稀盐酸 |
| C、 |
银 |
锌 |
 硝酸银溶液 硝酸银溶液 |
| D、 |
铜 |
铁 |
硝酸铁溶液 |
下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是
| A.产生气体体积①=② |
| B.①中阴极质量增加,②中正极质量减小 |
| C.溶液的pH变化:①减小,②增大 |
| D.电极反应式①中阳极:4OH-- 4e-= 2H2O+O2↑,②中负极:2H++2e-=H2↑ |
下图为两个原电池装置图,由此判断下列说法错误的是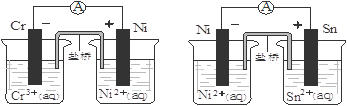
| A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同 |
| B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动 |
| C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应 |
| D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn |
普通锌锰干电池的简图(下图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽。在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O
关于锌锰干电池的下列说法中正确的是
| A.当该电池电压逐渐下降后,利用电解原理能重新充电复原 |
| B.电池负极的电极反应式为:2MnO2+2NH4++2e- = Mn2O3+2NH3+H2O |
| C.该电池碳棒可用铜棒代替,但是工作电压会下降 |
| D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5g |
试题篮
()