(1)下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以H2SO4溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为 。
在如图中,甲烧杯中盛有100 mL 0.50 mol/L AgNO3 溶液,乙烧杯中盛有100 mL 0.25 mol/L CuCl2溶液,A、B、C、D均为 质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g。
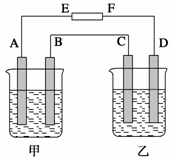
(1)电源E为________极
(2)A极的电极反应式为______________,析出物质______ mol。
(3)B极的电极反应式为______________,析出气体______ mL(标准状况)。
(4)D极的电极反应式为______________,析出气体______ mL(标准状况)。
(5)甲烧杯中滴入石蕊试液,________极附近变红,如果继续电离,在甲烧杯中最终得到______溶液。
肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4(l)ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)===N2(g)+2H2O(g)ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式__________。
(2)已知H2O(l)===H2O(g)ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为__________。
(3)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为__________。
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E周期序数等于E原子最外层电子数。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写)
(2)乙物质中存在的化学键类型是 。
(3)选用恰当的试剂除去D中少量的E,写出发生反应的化学方程式 。
(4)化合物乙的电子式 。
(5)将D、E的单质插入NAOH溶液中,构成原电池,其负极反应是 。
如图所示3套实验装置,分别回答下列问题: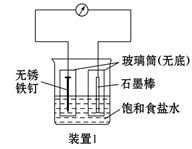
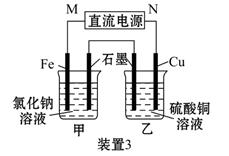
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______;向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
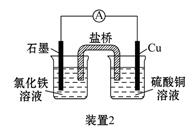
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为__________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为______________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为________ mL。
某化学研究性学习小组的同学在学习了电化学相关知识后,将所学知识整合得到如图所示装置,用于电解饱和食盐水。
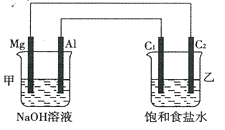
请回答下列问题:
(1)甲池中Al极为 极,乙池中C2极为 极;
(2)甲池中发生反应的总化学方程式为 ;
(3)若向乙池中滴加酚酞试液,则C1极附近观察到的现象为 ,C2极的电极反应式为 ;
(4)当C1极析出224mL气体(标准状况)时,转移电子的物质的量为 。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
 (1)该电池的负极材料是_________。电池工作时,电子流向____________(填“正极”或“负极”)。
(1)该电池的负极材料是_________。电池工作时,电子流向____________(填“正极”或“负极”)。
 (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。
 a.NaOH b.Zn c.Fe d.NH3·H2O
a.NaOH b.Zn c.Fe d.NH3·H2O
 (3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 __________。若电解电路中通过2 mol电子,MnO2的理论产量为_______g。
__________。若电解电路中通过2 mol电子,MnO2的理论产量为_______g。
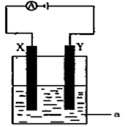
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
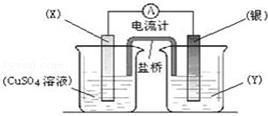
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极发生的电极反应为 ;
(3)X电极上发生的电极反应为 ;
下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
| A |
|
|
|
|
|||
| |
|
|
|
B |
C |
|
|
| D |
E |
|
|
|
|
F |
|
回答下列问题(对应物质书写相应化学式):
(1)元素B的元素符号为 ,它在元素周期表中的位置是 。
(2)D的简单离子的结构示意图为 ,它的最高价氧化物对应水化物中含有的化学键有 ,工业上冶炼D单质的化学方程式为 。
(3)用电子式表示EF2的形成过程 。
(4)由A2、C2构成碱性燃料电池,则该电池的负极反应方程式为 ,该电池工作过程中每通过2mol电子所需要的C2体积为 (标准状况)。
由铜、锌和稀硫酸组成的原电池中:
(1)锌是 极,电极反应式是 。
(2)铜是 极,电极反应式是 。
(3)在铜极上可以观察到有 (填实验现象)
(12分)
(一)大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq) I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的化学方程式为______,其反应△H=______。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3-(aq),其平衡常数表达式为 。
I3-(aq),其平衡常数表达式为 。
(二)能量之间可以相互转化:原电池可将化学能转化为电能。
(1)下列反应能设计成原电池的是: 。
①2FeCl3+Fe=3FeCl2.C
②AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③NaOH+HC1=NaC1+H2O
(2)根据(1)所选的反应设计成原电池如图,请在图中完成并作相应标注。
写出该电池的正极反应式: ,电池工作的时候,盐桥中的阴离子移向 (填“负极”,“正极”或“不移动”)。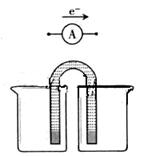
(3)用FeCl3溶液腐蚀印刷电路铜板的化学方程式为: ;
若将该反应设计成下图的原电池,请在图中完成电极材料及电解质溶液的标注。
(12分)(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。若1g水蒸气转化成液态水放热2.5kJ,则氢气的燃烧热为△H= kJ/mol。
(2)近年来已经研制出甲烷(CH4)燃料电池,该电池的电解质溶液为H2SO4溶液,写出该电池负极的电极反应式:____________________。该电池总反应式:________________________。
(3)用惰性电极电解AgNO3溶液,写出该电解反应的化学方程式 ;若在阳极收集到0.32 g O2,中和电解生成的酸需0.4 mol·L-1 NaOH溶液 mL。
(共13分)由铜、锌和稀硫酸组成的原电池中:
(1)锌是 极,电极反应式是 。
铜是 极,电极反应式是 。
总反应式
(2)在铜极上可以观察到 ,在锌极可以观察到 (填实验现象)
(3)下列装置能够组成原电池是( )
试题篮
()