(1)冶炼金属常用以下几种方法:①还原法,②电解法,③热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白。)
Ⅰ.Fe、Zn、Cu 等中等活泼金属 。
等中等活泼金属 。
Ⅱ.Na 、Mg、Al等活泼或较活泼金属 。
、Mg、Al等活泼或较活泼金属 。
Ⅲ.Hg、Ag等不活泼金属 。
(2)写出以锌片、铜片为两极,稀硫酸溶液为电解质溶液组成的原电池的电极反应式:
负极: ;正极: 。
利用下列反应:Fe+Cu2+===Fe2++Cu设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解质溶液自选),画出实验装置图,注明电解质溶液的名称和正负极材料,标出电子流动方向和电流方向,写出电极反应式。
右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH

(1)请回答图中甲、乙两池的有关问题:甲池是 装置,B(石墨)电极的名称是 。
(2)写出电极反应式:通入O2的电极的反应式 。A(Pt)电极的反应式为 ,
(3)乙池中反应的化学方程式为 。
(4)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中A极的质量增加5.40g时:
①甲池中理论上消耗O2体积为 (标准状况下);
②乙池中所得溶液的pH= 。
(12分)右图是铜锌原电池装置。其电池的总反应是:
Zn(s) + CuSO4(aq)="=" ZnSO4(aq) + Cu(s)。
请回答以下问题:
(1)R的名称是__________________,R中的阳离子移向_______(填A或B)中的溶液。
(2)电极Y的材料是________,B中的电解质溶液是________________。
(3)X为原电池的______极,其电极反应式是____________________________。
( 12分)从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限。
(1)上述图中的三种常用金属的开发利用之所以有先后,主要取决于
(填选项序号)
| A.金属的导电性强弱 | B.金属在地壳中的含量多少 |
| C.金属的化合价高低 | D.金属的活动性大小 |
(2)早在西汉成书的《淮南万毕术》里,就有"曾青得铁则化为铜"的记载。曾青又有空青、白青、石胆、胆矶等名称其实都是天然的硫酸铜。
①写出"曾青得铁则化为铜"的离子方程式 。
②若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式。
正极反应
负极反应 
③设计一个实验方案,使如图装置中的铁棒上析出铜,而铁的质量不变。(可用文字叙述也可用图示意)。
(3)铁路工人常用铝热反应来焊接钢轨,写出有关的化学方程式 。
教材中引发铝热反应的试剂是 。
如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
(1)酸式电池的电极反应:负极 ,正极 ;电池总反应: ;电解质溶液pH的变化 (填“变大”“变小”或“不变”)。
(2)碱式电池的电极反应:负极 ,正极 ;电池总反应: ;电解质溶液pH的变化 (填“变大”“变小”或“不变”)。
“可燃冰”是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中。据测定每0.1m3固体“可燃冰”要释放20m3的甲烷气体,“可燃冰”将成为人类的后续能源。“可燃冰”(用甲烷表示)燃烧的化学反应方程式为: ,若把该反应在一定条件下改装成原电池,则在原电池的负极发生反应的物质是: 。
按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为_______ B池为______
(2)锌极为______极,电极反应式为______________
铜极为______极,电极反应式为______________
石墨棒C1为_____极,电极反应式为__________
石墨棒C2为_____极,附近发生的实验现象为_____________
(3)当C2极析出224mL气体(标准状态)时,锌的质量变化(增加或减少)____、_____g,CuSO4溶液的质量变化了(增加或减少了)_____、____g
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如右图:
(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_____ _ ______;Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于_________,被腐蚀的金属是_____,Zn①极发生的腐蚀主要属于____________。
利用碳棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当碳棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。试计算:
(1)锌片的质量减少了多少?
(2)原稀硫酸溶液的物质的量浓度。
(3)有多少个电子通过了导线。
(1)在右图的银锌原电池中,银为 极,电极上发生的是 反应(“氧化”或“还原”),电极反应式是 。锌片上观察到的现象为 ,电极反应式为 。
(2)若反应过程中有0.2mol电子发生转移,则生成的铜为 g 。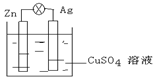
(本题共9分)化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 + CuCl2
② Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 (填反应序号),理由是 。
(二)请根据Zn + CuSO4 = ZnSO4 + Cu反应,选择适宜的材料和试剂设计一个原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极: ;负极: 。
将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是____________。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的pH均增大 |
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至
1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫
酸的物质的量浓度为_________________。
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:

①图中X溶液是 ;
②石墨电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 (填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极; ②图丙中的②线是 的变化。
③当电子转移为2 mol时,向乙烧杯中加入 L 5 mol·L-1 NaOH溶液才能使Cu2+沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
试题篮
()