金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解。
(1)写出铜溶于上述混合溶液的离子方程式 。
(2)若在如图Ⅰ所示的装置中发生(1)中的反应,
则X极是 (“正极”或“负极”),电极反应式是
(3)铜完全溶解时,所得溶液中Fe3+、Cu2+、H+三种阳离子的浓度均为0.2 mol/L(假设溶液体积不变),若用电解方法回收铜,装置如图Ⅱ所示。
①电解开始阶段,阳极的电极反应式为 ,阴极的电极反应式为 。
②判断溶液中的Cu2+已完全析出的现象是 。当Cu2+恰好完全析出时,转移电子的物质的量 。
根据所学知识回答下列问题,在如图所示装置中 ,
,
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 ,正极反应式为 ,负极反应式为 ,
该装置中的能量变化形式为 。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl+S+SO2。
请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,且SOCl2能与水反应。实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
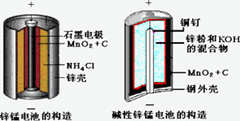
酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答问题
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
(1) 酸性锌锰干电池的负极反应为_________
(2) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式__________
(3) 维持电流强度为0.6A,电池工作10分钟,理论消耗Zn g。(结果保留到小数点后两位,F=96500C/mol)
(4) 用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:
①加入足量稀硫酸和_________溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为____到____之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀。
在Zn、Cu、稀硫酸组成的原电池中负极是 .正极反应式: , 电池总反应式:__ ___(离子方程式),电流从_ __极到__ 极,溶液中H+ 移向 _ _极,电池工作一段时间后电解质溶液PH值会变_ _
化学反应原理是探索化学反应内在的规律,是化学的精髓所在,也是化学的魅力所在。请利用化学反应原理的相关知识回答下列问题。
(1)寝室楼梯口挂着红色的灭火器,其中有一种泡沫灭火器是利用碳酸氢钠溶液和硫酸铝溶液反应生成大量的二氧化碳来灭火。请写出该反应的离子方程式: 。
(2)学校运动场边的铁制护网容易生锈,可以利用电化学腐蚀的原理来解释这一现象。请写出钢铁发生吸氧腐蚀的正极反应式: 。
(3)学校的锅炉房一般会定期去除锅炉水垢。水垢中含有的CaSO4,可先用Na2CO3溶液处理,而后用酸去除。请用一个离子方程式表示Na2CO3的作用: 。
(4)我们所使用的自来水一般要经过杀菌消毒处理,其中Cl2也曾用于自来水的消毒。工业上常用电解饱和食盐水的方法制取Cl2,请写出该反应的化学方程式: 。
(10分)
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应正极电极反应式为_______;放电时,CO32-移向电池的______(填“正”或“负”)极。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
请根据氧化还原反应Fe+2H+=Fe2++H2↑设计成原电池:
(1)负极材料为: 发生的电极反应是: ,电流 (填“流出”或“流入”)
(2)正极发生的电极反应是: 该反应为 (填“氧化反应”或“还原反应”)
(3)若电路中转移6.02×1022个e-,则产生标况下H2的体积为_ _。
(共13分)由铜、锌和稀硫酸组成的原电池中: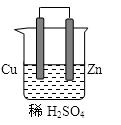
(1)锌是 极,电极反应式是 。
铜是 极,电极反应式是 。
总反应式
(2)在铜极上可以观察到 ,在锌极可以观察到 (填实验现象)
(3)下列装置能够组成原电池是( )
原电池是化学对人类的一个重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图所示装置。
①a和b不连接时,烧杯中发生的离子方程式是__________,
②a和b用导线连接,Cu极为原电池___极(填“正”或“负”),Zn极发生__________(填“氧化”或“还原”)反应。
③Zn片上发生的电极反应:____________________,Cu片上发生的电极反应:____________________。
(2)若a和b相连接,导线上转移0.2mol电子时,理论上Zn片质量减轻__________。
(10分)为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
(1)甲装置中,a电极的反应式为________________________________________。
(2)乙装置中,阴极区产物为_________________________。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_______(填“正”或“负”)极,该装置内发生反应的化学方程式为________________________________________________________。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为____________(不考虑气体的溶解)。
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:
(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_____ _ __;Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
试题篮
()