有甲、乙两个装置,下列说法错误的是
| A.甲、乙装置中,Zn的质量均减小 | B.甲、乙装置中,Cu上均有气泡产生 |
| C.化学反应速率 乙 > 甲 | D.甲中H+ 移向Zn,乙中H+ 移向Cu |
右图为一原电池的结构示意图,下列说法中,错误的是
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
写出下列反应的热化学方程式或电极反应式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量 。
(2)钢铁发生吸氧腐蚀时的正极电极反应式 。
(3)CH4与O2在酸性条件下形成原电池时,负极的电极反应式 。
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol e- 3H2+CO,每消耗1molCH4转移12mol e- |
| B.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
| C.电池工作时,CO32-向电极B移动 |
| D.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
关于下图所示的原电池,下列说法正确的是
| A.电子沿着盐桥从锌电极流向铜电极 |
| B.盐桥中的阳离子向硫酸铜溶液中迁移 |
| C.电流从锌电极通过电流计流向铜电极 |
| D.铜电极上发生的电极反应是2H++2e-===H2↑ |
磷酸铁锂电池结构如右图所示。左边由LiFePO4晶体组成,铝箔与电池一极连接;中间是聚合物隔膜,锂离子可以通过而电子不能通过;右边由石墨组成,铜箔与电池另一极连接,电池内充满电解质。在充电过程中LiFePO4中的锂离子脱出并伴随着铁元素的氧化。下列说法不正确的是
| A.放电时,铝箔所在电极为负极,铜箔所在电极为正极 |
| B.放电时,电池反应式为:FePO4+Li ="=" LiFePO4 |
| C.充电时, Li+向阴极移动 |
| D.充电时,阳极的电极反应式为:LiFePO4 – e— ="=" FePO4+Li+ |
铅蓄电池放电时的反应:PbO2+Pb+2H2SO4 =2PbSO4+2H2O,下列有关放电时的说法正确的是
| A.PbO2作正极,电极发生氧化反应 |
| B.当转移的电子数为3.01×1023时,参与反应的Pb的质量为103.5 g |
| C.负极的电极反应式是:Pb + SO42- - 2e- =PbSO4 |
| D.溶液中H+移向负极 |
在如图所示的原电池中,下列说法正确的是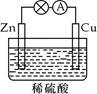
| A.负极发生还原反应 |
| B.正极反应为 Cu-2e-=Cu2+ |
| C.电子由铜片通过导线流向锌片 |
| D.反应一段时间后,溶液的酸性减弱 |
下列各变化中属于原电池反应的是( )。
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.镀锌铁表面有划损时,仍然能阻止铁被氧化 |
| C.红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
| D.锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快 |
锌铜原电池产生电流时,阳离子( )。
| A.移向Zn极,阴离子移向Cu极 | B.移向Cu极,阴离子移向Zn极 |
| C.和阴离子都移向Zn极 | D.和阴离子都移向Cu极 |
铜锌原电池(如图)工作时,下列叙述正确的是 
| A.正极反应为:Zn-2e-=Zn2+ |
| B.电池反应为:Zn+Cu2+=Zn2++Cu |
| C.当有1mol电子转移时,锌极减轻65g |
| D.盐桥中的K+移向ZnSO4溶液 |
有Fe2+、NO3-、Fe3+、NH4+、H+ 和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A.氧化剂与还原剂的物质的量之比为8:l |
| B.还原产物为NH4+ |
| C.若有l mol NO3-参加还原反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe 2+-e-=Fe 3+ |
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )

| A.电流从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阴离子交换膜 |
| C.电极A极反应式为:2NH3-6e-=N2+6H+ |
| D.当有4.48L NO2(标准状况)被处理时,转移电子为0.8mol |
某小组用右图装置进行实验,下列说法正确的是( )

| A.盐桥中的电解质可以用KC1 |
| B.闭合K,外电路电流方向为Fe电极→石墨电极 |
| C.闭合K,石墨电极上只生成铜 |
| D.导线中流过0.15 mol e-时,加入5.55 gCu2(OH)2CO3 ,CuSO4溶液可恢复原组成 |
试题篮
()