镍有电镀和化学镀两种方法,化学镀反应原理: .下列说法错误的是
.下列说法错误的是
| A.电镀镍时,Ni为阴极,镀件为阳极 |
| B.电镀和化学镀原理都是利用氧化还原反应 |
| C.化学镀无需通电,对镀件的导电性无特殊要求 |
D.化学镀中 中P化合价为+1,有强还原性 中P化合价为+1,有强还原性 |
右图是一款笔记本电脑所用甲醇燃料电池的结构示意图。

甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2 = 2CO2+4H2O 下列说法正确的是( )
| A.右电极为电池的正极,b处通入的物质是空气 |
| B.左电极为电池的负极,a处通入的物质是空气 |
| C.正极反应式为:CH3OH+H2O-6e-= CO2+6H+ |
| D.正极反应式为:O2+2H2O+4e-=4OH- |
右图的装置为实验室模拟铜的精练。以下叙述正确的是( )

| A.c为纯铜,d为粗铜 |
| B.实验前,铜片可用热碱溶液除油渍,盐酸除铜绿 |
| C.用含Cu2+的盐配成电解质溶液,电解后其浓度保持不变 |
| D.若阴极得到2摩尔电子,则阳极质量减少64克 |
化学与生产、生活密切相关。下列叙述中,不正确的是
| A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 |
| B.用活性炭为糖浆脱色和用臭氧漂白纸浆,原理不同 |
| C.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
| D.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 |
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________________________。
下列关于电解池的叙述中不正确的是( )
| A.与电源正极相连的是电解池的阴极 |
| B.与电源负极相连的是电解池的阴极 |
| C.在电解池的阳极发生氧化反应 |
| D.电子从电源的负极沿导线流入电解池的阴极 |
电解水﹙H2O﹚和重水﹙D2O﹚的混合物,通电一定时间后,两极共生成气体18.5克,体积为33.6L﹙标况﹚,所生成的气体中重氢﹙D﹚和普氢﹙H﹚的原子个数比是( )
| A.1:1 | B.1:2 | C.1:3 | D.1:4 |
磷酸铁锂电池结构如右图所示。左边由LiFePO4晶体组成,铝箔与电池一极连接;中间是聚合物隔膜,锂离子可以通过而电子不能通过;右边由石墨组成,铜箔与电池另一极连接,电池内充满电解质。在充电过程中LiFePO4中的锂离子脱出并伴随着铁元素的氧化。下列说法不正确的是
| A.放电时,铝箔所在电极为负极,铜箔所在电极为正极 |
| B.放电时,电池反应式为:FePO4+Li ="=" LiFePO4 |
| C.充电时, Li+向阴极移动 |
| D.充电时,阳极的电极反应式为:LiFePO4 – e— ="=" FePO4+Li+ |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
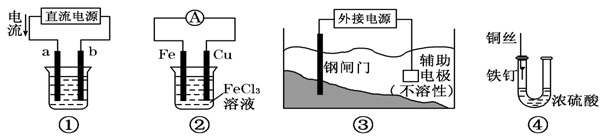
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
| A.NaOH、H2SO4、Ba(OH)2 | B.NaOH、CuSO4、H2SO4 |
| C.HCl、CuCl2、Ba(OH)2 | D.NaBr、H2SO4、Ba(OH)2 |
将0.1 mol AgNO3和0.2mol Cu(NO3)2固体溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.15 mol O2,此时,另一极上析出的气体体积(标准状况)为( )
| A.1.12L | B.2.24 L | C.3.36 L | D.4.48L |
下列各组溶液电解一段时间后,再加入相关物质,溶液能恢复原来组成的是
| |
电解质溶液 |
阳极 |
阴极 |
加入的物质 |
| A |
NaCl溶液 |
碳 |
铁 |
盐酸 |
| B |
稀硫酸 |
铜 |
碳 |
水 |
| C |
硫酸铜溶液 |
铜 |
碳 |
硫酸铜 |
| D |
NaOH溶液 |
碳 |
铁 |
水 |
在25 ℃时,用石墨电极电解2.0 L 0.5mol·L-1 CuSO4溶液。5min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题。
(1)发生氧化反应的是__________极,电极反应式为____________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为____________。
(3)若将溶液恢复到与电解前一样,则需加入________mol的_______。
下列说法正确的是( )
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 |
| B.铁片镀锌时,铁片与外电源的正极相连 |
| C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 |
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),通入少量O2, NO(g)+SO3(g),通入少量O2,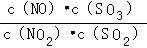 的值及SO2转化率不变 的值及SO2转化率不变 |
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题:
(1)M为电源的_____极(填“正”或“负”),电极b上发生的电极反应为__________________________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应_______________________。
(4)若电解过程中,乙烧杯中的B溶液中的金属离子全部析出,此时电解还能继续进行,原因是___________________________________。
(5)若经过一段时间后,测得乙烧杯中c电极质量增加了16 g,要使丙烧杯中的C溶液恢复到原来的状态,正确的操作是_____________________________________。
试题篮
()