关于下列各装置图的叙述不正确的是

| A.用图①装置精炼铜,a极为粗铜,电解质溶液为CuSO4溶液 |
| B.图②装置的盐桥中KCl的Cl-移向乙烧杯 |
| C.图③装置中钢闸门可与外接电源的负极相连受到保护 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 |
如图所示装置,均盛有等体积等浓度的稀硫酸,工作相同的时间后测得均通过n mol e-。下列叙述错误的是(不考虑溶液体积的变化)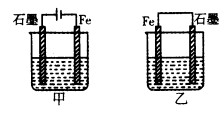
| A.铁棒的腐蚀程度:甲<乙 |
| B.碳电极上发生反应的电极反应式相同 |
| C.溶液的pH:甲减小,乙增大 |
| D.甲乙产生气体的体积(相同条件)比为3:2 |
某模拟“人工树叶”电化学实验装置如右图所示,该装置能将H2O和CO2转化 为O2和燃料(C3H8O)。下列说法正确的是
| A.该装置将化学能转化为光能和电能 |
| B.该装置工作时,H+从b极区向a极区迁移 |
| C.每生成1molO2,有44gCO2被还原 |
| D.a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O |
高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析,以下观点中不正确的是
①放热反应在常温下均能自发进行;
②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,化学反应只向吸热反应方向进行;
⑤盐类均能发生水解反应;
⑥化学平衡常数的表达式与化学反应方程式的书写无关。
| A.①②④⑤ | B.①④⑤⑥ | C.②③⑤⑥ | D.①②④⑤⑥ |
利用下列装置,可完成很多电化学实验。下列有关叙述,正确的是

| A.若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 |
B.若X为铜棒,开关K置于A处,装置中发生的总反应为:2NaCl+2H2O 2NaOH+Cl2+H2 2NaOH+Cl2+H2 |
| C.若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 |
| D.若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 |
关于下列装置的说法正确的是
| A.装置①中盐桥内的K+移向CuSO4溶液 |
| B.装置①将电能转变为化学能 |
| C.若装置②用于铁棒镀铜,则N极为铁棒 |
| D.若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变 |
500m L KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
①原混合溶液中c(K+)= 4mol·L-1②原混合溶液中c(K+)= 2mol·L-1
③电解得到的Cu的物质的量为0.5mol④电解后溶液中c(H+)=2mol·L-1
⑤向电解后的溶液中加入一定量的CuO可恢复为原溶液
⑥向电解后的溶液中加入一定量的Cu(OH)2可恢复为原溶液
⑦上述电解过程中共转移了4mol电子⑧电解后溶液中c(H+)=4mol·L-1
| A.②⑥⑦⑧ | B.①④⑤⑦ | C.②⑤⑦⑧ | D.①③④⑥ |
将含有0.4molNaCl和0.4molCu(NO3)2的水溶液1L用惰性电极电解一段时间后,在一个电极上析出0.3molCu,此时在另一个电极上放出气体的体积(标准状况)约为
| A.6.72L | B.5.6L | C.2.8L | D.13.44L |
用惰性电极电解下列溶液,其中随着电解的进行,溶液pH逐渐减小的是( )
①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸 ⑥硫酸钠溶液
| A.①③⑤ | B.②④⑤ | C.②④ | D.②④⑥ |
下列四个装置图均与电化学有关,请根据图示回答相关问题:
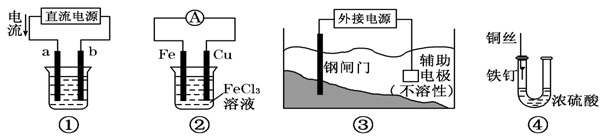
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
| A.NaOH、H2SO4、Ba(OH)2 | B.NaOH、CuSO4、H2SO4 |
| C.HCl、CuCl2、Ba(OH)2 | D.NaBr、H2SO4、Ba(OH)2 |
将0.1 mol AgNO3和0.2mol Cu(NO3)2固体溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.15 mol O2,此时,另一极上析出的气体体积(标准状况)为( )
| A.1.12L | B.2.24 L | C.3.36 L | D.4.48L |
下列各组溶液电解一段时间后,再加入相关物质,溶液能恢复原来组成的是
| |
电解质溶液 |
阳极 |
阴极 |
加入的物质 |
| A |
NaCl溶液 |
碳 |
铁 |
盐酸 |
| B |
稀硫酸 |
铜 |
碳 |
水 |
| C |
硫酸铜溶液 |
铜 |
碳 |
硫酸铜 |
| D |
NaOH溶液 |
碳 |
铁 |
水 |
在25 ℃时,用石墨电极电解2.0 L 0.5mol·L-1 CuSO4溶液。5min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题。
(1)发生氧化反应的是__________极,电极反应式为____________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为____________。
(3)若将溶液恢复到与电解前一样,则需加入________mol的_______。
下列说法正确的是( )
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 |
| B.铁片镀锌时,铁片与外电源的正极相连 |
| C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 |
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),通入少量O2, NO(g)+SO3(g),通入少量O2,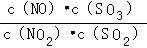 的值及SO2转化率不变 的值及SO2转化率不变 |
试题篮
()