碘盐中添加的碘酸钾在工业上可用电解KI溶液制取,电极材料是石墨和不锈钢,化学方程式是:KI+3H2O KIO3+3H2↑,有关说法不正确的是
KIO3+3H2↑,有关说法不正确的是
| A.石墨作阳极,不锈钢作阴极 |
| B.I-在阳极放电,H+在阴极放电 |
| C.电解过程中电解质溶液的pH变小 |
| D.电解转移3 mol e-时,理论上可制得KIO3 107 g |
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
A.当电池负极消耗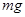 气体时,电解池阴极有 气体时,电解池阴极有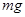 气体生成 气体生成 |
| B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
C.电解后,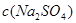 不变,且溶液中有晶体析出 不变,且溶液中有晶体析出 |
D.电池中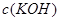 不变;电解池中溶液 不变;电解池中溶液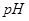 变大 变大 |
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是
| A.CuCl2 [CuSO4] |
| B.NaOH [NaOH] |
| C.NaCl [HCl] |
| D.CuSO4 [Cu(OH)2] |
关于原电池和电解池的叙述正确的是
| A.原电池失去电子的电极称为阴极 |
| B.电解池的阳极、原电池的负极都发生氧化反应 |
| C.原电池的两极,一定要由活动性不同的两种金属组成 |
| D.电解时电解池的阳极一定是阴离子放电 |
关于电解NaCl水溶液,下列叙述正确的是
| A.电解时在阳极得到氯气,在阴极得到金属钠 |
| B.若在阳极附近的溶液中滴入淀粉KI溶液,溶液呈蓝色 |
| C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 |
| D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 |
用惰性电极电解下列溶液,一段时间后,加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是
| A.CuCl2[CuO] | B.NaOH[NaOH] | C.NaCl[HCl] | D.CuSO4[CuSO4] |
CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
| A.电能全部转化为化学能 |
| B.粗铜接电源正极,发生氧化反应 |
| C.溶液中Cu2+向阳极移动 |
| D.利用阳极泥可回收Ag、Pt、Au等金属 |
如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是:
| A.从E口逸出的气体是H2 |
| B.从B口加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH |
| D.粗盐水中含Ca2+、Mg2+、Fe3+、SO等离子,精制时先加Na2CO3溶液 |
右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中错误的是
| A.a电极附近呈蓝色,b电极附近呈红色 |
| B.a电极附近呈红色,b电极附近呈蓝色 |
| C.逸出气体的体积,a电极的大于b电极的 |
| D.a、b两电极都逸出无色无味气体 |
设NA为阿伏伽德罗常数的值。下列叙述正确的是
| A.2.4 g镁变为镁离子失去的电子数为0.1NA |
| B.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g |
| C.标准状况下,2.24L四氯化碳含有分子的数目为0.1NA |
| D.常温常压下,Na2O2与足量H2O反应,当生成0.2molO2时,转移电子的数目为0.4NA |
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是
| A.CuCl2(CuO) | B.NaOH(NaOH) | C.NaCl(HCl) | D.CuSO4[Cu(OH)2] |
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。电解时,下列有关叙述正确的是(已知氧化性Fe2+<Ni2+<Cu2+)
| A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— = Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
试题篮
()