如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间。假设在电解过程中产生的气体全部逸出,下列说法正确的是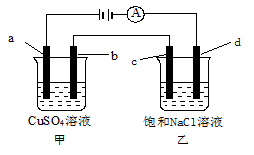
| A.甲、乙两烧杯中溶液的pH均保持不变 |
| B.当b极增重3.2 g时,d极产生的气体为0.56 L(标准状况) |
| C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 |
| D.甲烧杯中a电极反应式为:4OH--4e-===O2↑+2H2O |
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
| A.NaOH、H2SO4、Ba(OH)2 | B.NaOH、CuSO4、H2SO4 |
| C.HCl、CuCl2、Ba(OH)2 | D.NaBr、H2SO4、Ba(OH)2 |
右图是一款笔记本电脑所用甲醇燃料电池的结构示意图。

甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2 = 2CO2+4H2O 下列说法正确的是( )
| A.右电极为电池的正极,b处通入的物质是空气 |
| B.左电极为电池的负极,a处通入的物质是空气 |
| C.正极反应式为:CH3OH+H2O-6e-= CO2+6H+ |
| D.正极反应式为:O2+2H2O+4e-=4OH- |
将0.1 mol AgNO3和0.2mol Cu(NO3)2固体溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.15 mol O2,此时,另一极上析出的气体体积(标准状况)为( )
| A.1.12L | B.2.24 L | C.3.36 L | D.4.48L |
为增强铝的耐腐蚀性,现以铅蓄电池为外接电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2↑,在电解过程中,以下判断正确的是
Al2O3+3H2↑,在电解过程中,以下判断正确的是
用碱性氢氧燃料电池为电源进行电解的实验装置示意图如下所示。下列说法中正确的是
| A.燃料电池工作时,负极反应为:H2-2e- = 2H+ |
| B.若要实现铁上镀铜,则a极是铁,b极是铜 |
| C.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下当电池中消耗H222.4L(标准状况)时,a极析出铜64g |
在盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电一段时间后
| A.溶液的pH增大 | B.Na+ 和CO32-的浓度减小 |
| C.溶液的浓度增大 | D.溶液的浓度不变,有晶体析出 |
有关下列装置的叙述不正确的是( )
① ②
② ③
③ ④
④
| A.图①铝片发生的电极反应式是:Al+4OH--3e-=AlO2-+2H2O |
| B.图②发生析氢腐蚀,离子反应方程式为:Fe+2H+=Fe2++H2↑ |
| C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.图④充电时,阳极反应是:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
将含有0.4molNaCl和0.4molCu(NO3)2的水溶液1L用惰性电极电解一段时间后,在一个电极上析出0.3molCu,此时在另一个电极上放出气体的体积(标准状况)约为
| A.6.72L | B.5.6L | C.2.8L | D.13.44L |
下列各组溶液电解一段时间后,再加入相关物质,溶液能恢复原来组成的是
| |
电解质溶液 |
阳极 |
阴极 |
加入的物质 |
| A |
NaCl溶液 |
碳 |
铁 |
盐酸 |
| B |
稀硫酸 |
铜 |
碳 |
水 |
| C |
硫酸铜溶液 |
铜 |
碳 |
硫酸铜 |
| D |
NaOH溶液 |
碳 |
铁 |
水 |
对于金属冶炼的工业方法,下列有关说法中正确的是
| A.可用电解饱和的MgCl2溶液的方法获得金属镁 |
| B.电解CuSO4溶液精炼金属铜时,用铁做阳极 |
| C.电解熔融Al2O3方法冶炼金属铝时,同时要加入冰晶石作助熔剂 |
| D.工业上常采用活泼金属还原法冶炼金属银 |
图装置可处理乙醛废水,乙醛在阴、阳极分别转化为乙醇和乙酸。下列说法正确的是
| A.b电极为正极 |
| B.电解过程中,阴极区Na2SO4的物质的量增大 |
| C.阳极电极反应式为CH3CHO-2e-+H2O===CH3COOH+2H+ |
| D.电解过程中,阴、阳极还分别产生少量的O2和H2 |
下列关于铜电极的叙述中正确的是
| A.铜锌原电池中铜是负极 |
| B.用电解法精炼粗铜时粗铜作阳极 |
| C.在铁上电镀铜时用铜作阴极 |
| D.电解稀硫酸时用铜作阳极,阳极产生氧气 |
试题篮
()