亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3  H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式____________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中c (H+) = 2.5×10-2 mol·L-1,除OH-之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中
c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为________________________。
②产品室中反应的离子方程式为________________。
雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。

图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ•mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
| A.第10min后,向该容器中再充入1molCO2和3molH2,则再次达到平衡时c(CH3OH) ="1.5" mol/L |
| B.达到平衡时,氢气的转化率为0.75 |
| C.0~10分钟内,氢气的平均反应速率为0.075mol/(L•min) |
| D.该温度下,反应的平衡常数的值为3/16 |
E.升高温度将使n(CH3OH)/n(CO2)增大
(3)某种脱硫工艺中将烟气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程为 。
(4)电化学降解NO3- 的原理如题22-3图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)  4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将___(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L—1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为______________。
③一定温度下,在2L恒容密闭容器中加入2mol N2O5,达到平衡时,气体的压强为原来的 ,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的__________区生成,其电极反应式为_________________________________。
(3)如图:V(NO):V(O2)=3:1。当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态)。当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm。假设温度不变,且隔板及U形毛细管的体积都忽略不计,此时混合气体的平均相对分子质量为__________。 
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%﹥b% C. a%﹤b%
③甲中的离子交换膜为 (填“阳离子交换膜”或“阴离子交换膜”)。
(3)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的4种钠盐溶液pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中,不正确的是 (填字母)
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)
Ⅰ.在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率ν(CO)=_______ mol/(L·min),此时该反应的平衡常数为 。 
(2)当下列哪些物理量不再发生变化时,表明上述反应已达到平衡状态的是 。
| A.混合气体的压强 |
| B.混合气体的密度 |
| C.CO的物质的量浓度 |
| D.密闭容器中放出热量 |
E.ν(CO)与ν(CO2)的比值
Ⅱ.亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。 
(3)配平Ⅰ中反应方程式 ClO3-+ H++ SO32-== ClO2↑+ SO42-+
(4)A的化学式是 ,。生成气体a的电极反应式 。
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO:和0. 40 molNH3 ,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
30 |
70 |
80 |
100 |
| n(CO2) /mol |
0.10 |
0.060 |
0.040 |
0.040 |
0.040 |
①20 min时,υ正(CO2 )_ 80 min时。υ逆(H2O)(填“>”、“=”或“<”)。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将_ (填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_ (保留二位小数)。
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图像;保持其它条件不变;则(t+10)℃下正确的图像可能是 (填图甲中的“A”或“B”)。
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,若两极共收集到气体22. 4L(标
况),则消耗的尿素为 g(忽略气体的溶解)。
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ,ΔH=—76.0 kJ·mol-1,该反应中每放出38 kJ热量,转移电子的物质的量为 mol.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO20.2mol·L—1,H20.8mol·L—1, CH40.8mol·L—1,H2O1.6mol·L—1,起始充CO2和H2的物质的量分别为 、 。CO2的平衡转化率为
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充人1 mot CO2,和4 molH2,在II中充人1 mol CH4和2 mol H2 O(g) , 300℃下开始反应。达到平衡时,下列说法正确的是 (填字母)。
| A.容器I、II中正反应速率相同 |
| B.容器I、II中CH4的物质的量分数相同 |
| C.容器I中CO2的物质的量比容器II中的多 |
| D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1 |
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
①上述生产过程的能量转化方式是
②上述电解反应在温度小于900 0C时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被__________ (填“氧化”还是“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:
①步骤1中反应的离子方程式是_______________。
②步骤2所加的氧化剂最适宜的是____________________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为__________
[Ksp(Fe(OH)3)=4×10-38],可选用的“试剂1”是__________(写出一种即可)。
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是_______________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
(3)欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。并写出电极反应式。
铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理 .
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
①写出反应I中主要发生的氧化还原反应的离子方程式 .
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为 .
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为 g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为 .
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
以食盐为原料进行生产并综合利用的某些过程如下图所示:
(1)为除去粗盐中的Ca2+、Mg2+和SO ,得到纯净的NaCl晶体,需加入以下试剂:
,得到纯净的NaCl晶体,需加入以下试剂:
| A.过量的NaOH溶液; | B.过量的Na2CO3溶液; | C.适量的盐酸; | D.过量的BaCl2溶液。 |
正确的加入顺序是_______,还缺少的操作步骤是__________和___________。
(2)将滤液的pH调至酸性除去的离子是________,发生反应的离子方程式为________。
(3)若用惰性电极电解200mL1.5mol/L食盐水,当电解2min时,两极共收集到448mL气体(标准状况下)。假设电解前后溶液的体积不变,则电解后该溶液的pH为______。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是___________。
(5)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述)_____________。
②常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。则反应前的溶液中与反应后的滤液中水电离出的 (OH-)的比值是_________。
(OH-)的比值是_________。
碘及其化合物在人类活动中占有重要地位。
(1)加碘食盐中含有碘酸钾(KIO3),工业上以电解法制备碘酸钾,电解设备如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:
3I2+6KOH=5KI+KIO3+3H2O,再将该溶液加入 (阴极、阳极)区,另将氢氧化钾溶液加入另外一个区。使用 (阴、阳)离子交换膜,在阳极发生的电极反应式: 。
(2)碘化氢不稳定,分解反应的热化学方程式是2HI(g) I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
①该反应属于( )
A.任何温度均自发 B.任何温度均不自发 C.高温自发 D.低温自发
②一定条件下,反应在一个带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温,缩小体积,平衡常数不变
B.恒温,缩小体积,平衡不移动,颜色加深
C.恒容,升温,正向反应速率和逆向反应速率均增大
D.恒容,在容器中若投入2mol HI,达到平衡时吸收9.48 kJ 的热量
③一定温度下,平衡常数K=1/4,在2L的容器中,加入4molHI发生反应达到平衡,HI的转化率 。
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图所示。
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s);△H=-235.8 kJ/mol。
己知:2 Ag2O(s)=4Ag(s)+O2(g);△H=+62.2kJ/mol,则O3转化为O2的热化学方程式为 ;②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为 。
| 时间/min浓度(mol/L) |
NO |
N2 |
CO2 |
| 0 |
1.00 |
0 |
0 |
| 10 |
0.58 |
0.21 |
0.21 |
| 20 |
0.40 |
0·30 |
0.30 |
| 30 |
0.40 |
0.30 |
0.30 |
| 40 |
0.32 |
0.34 |
0.17 |
| 50 |
0.32 |
0.34 |
0.l7 |
(2)用活性炭还原法处理氮氧化物,有关反应为: C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10 min~20 min以内v(CO2)表示的反应速率为
②根据表中数据,计算T1℃时该反应的平衡常数K= (保留两位小数);
③下列各项能作为判断该反应达到平衡状态的是 (填序号字母);
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是 ;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
某厂废水中含量金属Cr3+(含有少量Fe3+、Cu2+)。某研究性学习小组为了变废为宝,将废水处理得到重铬酸钾。某含铬废水处理的主要流程如图所示:
已知:① 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:
回答下列问题:
(1)滤渣的成分是 。(写化学式)
(2)写出第③步反应的离子方程式 。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有 。
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下:
电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比 为d,则此时的铬酸钾的转化率为 。
为d,则此时的铬酸钾的转化率为 。
高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为MnO2)生产髙锰酸钾分为两个步骤。
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是______________。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在_______(填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是_______。
(2)某研究小组用工业生产高锰酸钾产生的废渣——猛泥(含K2MnO4、MnO2及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下: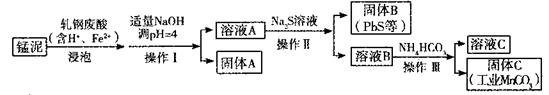
③轧钢废酸中Fe2+的作用是______________。
④操作I、操作II、操作III的名称是_______。
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是_______。
⑥若固体C中不含CaCO3,则溶液D中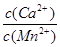 <_______。
<_______。
[已知:Ksp(MnCO3)=1×10—11,Ksp(CaCO3)=5×10—9]
试题篮
()