二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。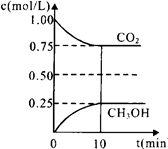
①能说明该反应已达平衡状态的是______ __。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化。
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O。 D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
②下列措施中能使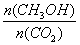 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g) C.将H2O(g)从体系中分离
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=__________。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如下图1所示。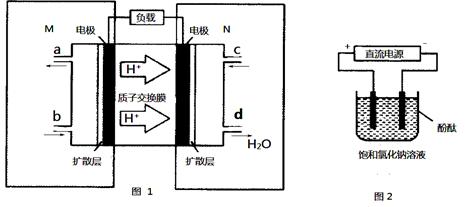
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用上图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为________________________。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
新的研究表明二甲醚(DME)是符合中国能源结构特点的优良车用替代燃料,二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):
①CH3OCH3(g) + H2O(l)  2 CH3OH(l) △H=+24.52kJ/mol
2 CH3OH(l) △H=+24.52kJ/mol
②CH3OH(l) + H2O(l)  CO2(g) + 3H2(g) △H=+49.01kJ/mol
CO2(g) + 3H2(g) △H=+49.01kJ/mol
③CO(g) + H2O(l)  CO2(g) + H2(g) △H=-41.17kJ/mol
CO2(g) + H2(g) △H=-41.17kJ/mol
④CH3OH(l)  CO (g) + 2H2(g) △H=+90. 1kJ/mol
CO (g) + 2H2(g) △H=+90. 1kJ/mol
请回答下列问题:
(1)写出用二甲醚制H2同时全部转化为CO2时反应的热化学方程式 。
(2)200℃时反应③的平衡常数表达式K= 。
(3)在一常温恒容的密闭容器中,放入一定量的甲醇如④式建立平衡,以下可以作为该反应达到平衡状态的判断依据为_______。
A.容器内气体密度保持不变 B.气体的平均相对分子质量保持不变
C.CO的体积分数保持不变 D.CO与H2的物质的量之比保持1:2不变
(4)工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,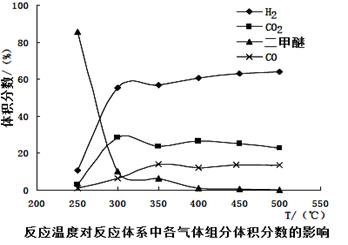

①你认为反应控制的最佳温度应为___________。
A.300~350℃ B.350~400℃
C.400~450℃ D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是__________(用相应的化学方程式表示)。
(5)某一体积固定的密闭容器中进行反应②,200℃时达平衡。请在下图补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,CO2的百分含量随时间变化图像。
(6)一定条件下,如图示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为 。
工业废水中常含有一定量的Cr2O,会对人类及生态系统产生很大损害,电解法是行之有效的除去铬的方法之一。该法用Fe和石墨作电极电解含Cr2O 的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如下图所示。
的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如下图所示。
(1)Fe电极为 (填“M”或“N”);电解时 (填“能”或“不能”)否用Cu电极来代替Fe电极,理由是 。
(2)阳极附近溶液中,发生反应的离子方程式是
阴极附近的沉淀有 。
(3)图中熔融盐燃料电池是以熔融碳酸盐为电解质、CH4为燃料、空气为氧化剂、稀土金属材料为电极的新型电池。已知,该熔融盐电池的负极的电极反应是CH4–8e–+4CO32–==5CO2+2H2O,则正极的电极反应式为 。
(4)实验过程中,若电解池阴极材料质量不变,产生4.48L(标准状况)气体时,熔融盐燃料电池消耗CH4的体积为 L(标准状况)。
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。

①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.c ( H2 )减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c ( H2 )/ c (CH3OH )减小 E.平衡常数K增大 |
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程

①写出阳极电极反应式 。
②请写出除去甲醇的离子方程式 。
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g)。该反应在石英真空管中进行,如下图所示:
WI2(g)。该反应在石英真空管中进行,如下图所示:
①该反应的平衡常数表达式K=_______,若K=1/2,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②该反应的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质____。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)利用“隔膜电解法”处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式)。
②电解池阳极区的电极反应式为_________________。
③在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
(15分)某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02。某工厂利用此矿石炼制精铜的工艺流程示意图如下: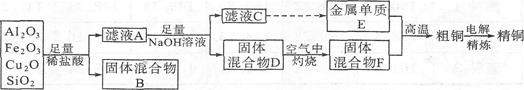
已知:CuO2+2H+=Cu+Cu2++H2O
(1)滤液A中铁元素的存在形式为 (填离子符号),生成该离子的离子方程式为 ,检验滤液A中存在该离子的试剂为 (填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为 。
(3)常温下.等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH一)前者为后者的108倍,则两种溶液的pH= 。
(4)将Na2CO3溶液滴入到一定量的CuCl2溶液中,除得到蓝色沉淀,还有无色无味气体放出,写出相应的离子方程式: 。
(5)①粗铜的电解精炼如图所示。在粗铜的电解精炼过程中,c为粗铜板,则a端应连接电源的 (填“正”或“负”)极,若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有 、 。
②可用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是 、滴定中发生反应的离子方程式为 , 滴定时.锥形瓶中的溶液接触空气,则测得铁元素的含量会 (填“偏高”或“偏低”)。
(1)在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)
 2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是 (填序号字母)
2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是 (填序号字母)
a.0~t1时,v正>v逆 ,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO2和0. 40 molNH3,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
20 |
70 |
80 |
100 |
| n(CO2) /mol |
0.10 |
0.060 |
0.020 |
0.020 |
0.020 |
①20 min时,平均反应速率υ (CO2 )= mol/L·min。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将 (填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_ (保留一位小数)。
④下图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,
(3)CH4燃料电池,装置示意如图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。当 V="44.8" L时,电池总反应方程式为 ;用该电池为电源,以石墨作电极,电解上述实验分离出的溶液,两极均产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是________________。
Ⅰ、醉驾对人们的安全危害很大,利用下列原理可以检查司机是否酒后开车。
2K2Cr2O7(橙色)+3C2H5OH+H2SO4 →Cr2(SO4)3(绿色)+K2SO4+CH3COOH+H2O
①配平化学方程式后,H2O前面的系数为 ;
②怎样判断司机是酒后开车: 。
③写出用粮食酿酒的化学方程式: ; 。
Ⅱ、下列框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子。据此回答下列问题:
(1)A的组成是 (填化学式)。
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是 。
(3)A中某组分可由单质与水反应制得,化学方程式为: 。
(4)电解所用装置如图所示。
①电解开始阶段,阳极上的电极反应是 ,阴极上的电极反应是 。
②电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小的顺序是 。
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| C(NO)10-4 mol/L |
10.0 |
4.50 |
C1 |
1.50 |
1.00 |
1.00 |
| C(NO)10-3 mol/L |
3.60 |
3.05 |
C2 |
2.75 |
2.70 |
2.70 |
则c1合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.3.50 D.2.50
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
则曲线Ⅰ对应的实验编号依次为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
CO |
H2 |
|||
| ① |
650 |
2 |
4 |
2.4 |
1.6 |
5 |
| ② |
900 |
1 |
2 |
1.6 |
0.4 |
3 |
| ③ |
900 |
a |
b |
c |
d |
t |
①实验组①中以v(CO2)表示的反应速率为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为
α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。
②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
煤粉中的氮元素在使用过程中的转化关系如下图所示:
(1)②中NH3参与反应的化学方程式为 。
(2)③中加入的物质可以是 (填字母序号)。
a.空气 b.CO c.KNO3 d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶( ),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
(4)已知:N2(g) + O2(g) 2NO(g) ΔH =" a" kJ·mol-1
2NO(g) ΔH =" a" kJ·mol-1
N2(g) + 3H2(g) 2NH3(g) ΔH =" b" kJ·mol-1
2NH3(g) ΔH =" b" kJ·mol-1
2H2(g) + O2(g) 2H2O(l) ΔH =" c" kJ·mol-1
2H2O(l) ΔH =" c" kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为 。
(5)用间接电化学法除去NO的过程,如下图所示:
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式: 。
用离子方程式表示吸收池中除去NO的原理: 。
I.下图为相互串联的三个装置,试回答: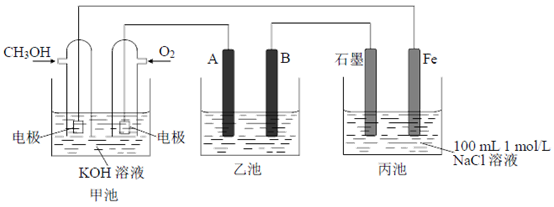
(1)若利用乙池在铁片上镀银,则B是_________(填电极材料),电极反应式是_________;应选用的电解质溶液是_____________。
(2)若利用乙池进行粗铜的电解精炼,则________极(填“A”或“B”)是粗铜,若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____________________。
(3)丙池滴入少量酚酞试液,电解一段时间___________(填“C”或“Fe”)极附近呈红色。
(4)写出甲池负极的电极反应式:________________________________。若甲池消耗3.2gCH3OH气体,则丙池中阳极上放出的气体物质的量为______________。
II.(5)请利用反应Fe +2Fe3+= 3Fe2+设计原电池。
设计要求:①该装置尽可能提高化学能转化为电能的效率;
②材料及电解质溶液自选,在图中做必要标注;
③画出电子的转移方向。
H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)空气阴极法电解制备H2O2的装置如下图所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物。试回答:

①直流电源的a极名称是 。
②阴极电极反应式为 。
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2。相对于电解法,该方法具有的优点是安全、 。
(2)Fe3+对H2O2的分解具有催化作用。利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。

(3)用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。反应的离子方程式是 ,控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| Cu的平均溶解速率 (×10-3mol·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
(14分)铬(Cr)是周期表中VIB族元素,化合价可以是 0 ~+6 的整数价态。回答下列问题:
(1)某铬化合物的化学式为 Na3CrO8,其阴离子结构可表示为 ,则Cr的化合价为 。
,则Cr的化合价为 。
(2)在如图装置中,观察到Cu电极上产生大量的无色气泡,Cr电极周围出现天蓝色(Cr2+) ,而后又变成绿色 (Cr3+)。该电池总反应的过程表示为: ,2Cr2++2H+= 2Cr3++ H2。左侧烧杯溶液中c(Cl-) (填“增大”,“减小”或“不变”)。
(3)已知Ksp(BaCrO4)=1.2×10-10, Ksp(PbCrO4)= 2.8×10-13, Ksp(Ag2CrO4)= 2.0×10-12。某溶液中含有Ba2+、Pb2+、Ag+,浓度均为0.01 mol/L ,向该溶液中逐滴入 0.01 mol/L Na2CrO4溶液时,三种阳离子产生沉淀的先后顺序为 。
(4)在溶液中存在如下平衡:
则反应 的平衡常数K= 。
的平衡常数K= 。
(5)CrO2-4呈四面体构型,结构为 。CrO2-7由两个CrO2-4四面体组成,这两个CrO2-4四面体通过共用一个顶角氧原子彼连,结构为
。CrO2-7由两个CrO2-4四面体组成,这两个CrO2-4四面体通过共用一个顶角氧原子彼连,结构为 。则由n(n>1)个CrO2-4通过角顶氧原子连续的链式结构的化学式为 。
。则由n(n>1)个CrO2-4通过角顶氧原子连续的链式结构的化学式为 。
(6)CrO3是H2CrO4的酸酐,受热易分解。把一定量的 CrO3加热至790K时,残留固体的质量为原固体质量 76%。写出 CrO3受热分解化学方程式: 。
(共16分)Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:

①燃料电池即电源的N极的电极反应式为 _______________________ ;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)  N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂
C.减小CO2的量 D.扩大容器体积
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。
②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为 。
实验室制备气体B的化学方程式为 ,为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知I2+2S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是 ;
②根据上述步骤可计算出原ClO2溶液的浓度为 g /L(用含字母的代数式表示)。
试题篮
()