电化学在化学工业有着广泛的应用,
(1)工业冶炼铝的化学方程式是 ;
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
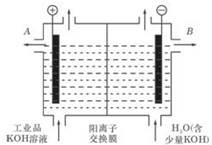
①该电解槽的阳极反应式是 ;
②除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
(3)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)
Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)
是一种新型净水剂.用下面装置可以制取少量高铁酸钠。
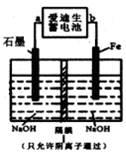
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是 。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式 。
如图,A为直流电源,B为电解槽,c、d为石墨电极,B中存放有100mL NaCl和CuCl2的混合溶液,其中Cu2+的物质的量浓度为0.1mol/L,闭合K,d极收集到标准状况下448mL的一种气体甲,该气体能使湿润的碘化钾淀粉试纸变蓝。气体体积均
在标准状况下测定,假设溶液的体积变化忽略不计,不考虑
电解产生的气体溶解和吸收。请回答下列问题。

(1)A电源的a极是
(2)计算c极理论上收集到的气体的体积是 (标准状况下)。
(3)假设100mL溶液中,c(Cu2+)="a" mol/L,c(Na+)="b" mol/L,Cu2+完全放电后,理论上d极产生甲气体的体积V范围是 (用带a、b的代数式表示)。
金属冶炼和金属化合物处理常涉及氧化还原反应。

(1)若用惰性电极电解饱和NaCl溶液一段时间当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH =__________。
(2)利用反应2Cu+O2+2H2SO4=CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
(3)右图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族;E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6。
(1)E在元素周期表中的位置是 。
(2)由A、C、F三种元素按原子个数比1∶1∶1组成的化合物与BA3反应生成B的单质, 写出该反应的化学方式 。
(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的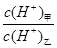 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(4)用图所示装置电解由D与F形成盐的饱和溶液时,若阴、阳极都用铁作电极,则阳极的电极反应式为 ,溶液中出现的现象是 。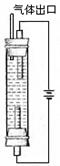
A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末, C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
回答下列问题:
(1)B的化学式: 。
(2)写出反应⑦的离子方程式 。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式 。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在 (填“阴、阳”)极附近溶液由无色变为红色,其原因是 。
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺:将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为:2CuFeS2 + 2SiO2+5O2=2Cu+2FeSiO3+4SO2该反应的氧化剂是 。
(2)下列处理SO2的方法,不合理的是_____
A高空排放 B用纯碱溶液吸收制备亚硫酸钠
C用氨水吸收后,再经氧化制备硫酸铵 D用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO 、Fe2O3 、SiO2、Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中未涉及到的操作有 。
A过滤 B加过量NaOH溶液 C蒸发结晶 D灼烧 E加氧化剂
II.FeCl3溶液浸取工艺:其生产流程如下图所示
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为 ____________。
(5)该工艺流程中,可以循环利用的物质是____ (填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时溶液中Pb2+物质的量浓度为 mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
已知下图中物质M是由同一短周期的两种元素组成的离子化合物,焰色反应为黄色,阴离子元素最高正价与它的负价代数和为6。X具有漂白性,Y为碱性气体, W是对空气无污染的气体。试回答下列问题:
(1)写出电解M溶液①的化学方程式 。
(2)写出实验室制取Y气体的化学方程式 。
(3)若A是一种常见金属,写出反应②的化学方程式 。
(4)若A是某元素的一种常见酸性氧化物,写出反应③的离子方程式 。
(5)写出X的电子式 和Z的结构式 。
(6)写出反应⑤的化学方程式 。
(7)标准状况下反应⑥中生成11.2L W时转移的电子数 。(用NA表示阿佛加德罗常数)
(14分)A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物, A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置是 ;
(2)检验C溶液中阳离子方法是(写出操作,现象及结论)
;
(3)写出反应①化学方程式: ;
(4)写出反应④离子方程式: ;
(5)写出反应⑥化学方程式: ;
(6)写出反应③阳极的电极反应式: ;
(7)从能量变化角度看,反应①②③中,属于△H<0的反应是 (填序号)。
铝是用途广泛的金属材料,目前工业上主要用铝土矿(主要成分含氧化铝、氧化铁)来制取铝,其常见的过程如下: 
请回答下列问题:
(1)沉淀B的化学式为 ,溶液C中阴离子主要是 。
(2)操作Ⅰ是 (填操作名称)
(3)写出①过程中发生反应的离子方程式 。
(4)Al(OH)3沉淀必须进行洗涤才能通过操作Ⅳ获得纯净Al2O3,操作Ⅳ是 (填操作名称),简述洗涤沉淀的操作方法: 。
(5)生产过程中,除水、CaO和CO2可以循环使用外,还可循环使用的物质有 (填化学式)。
(6)电解Al2O3制取金属Al的阳极电极反应式为 。
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ 和沉淀Ⅲ (填化学式),则pH1 pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则反应③的化学方程式是 。第③步反应后,过滤沉淀时需要的玻璃仪器有 。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、 。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式 。
下表为部分短周期元素化合价及其相应原子半径的数据。请回答下列问题: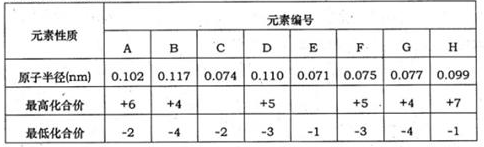
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 。
(2)A、B、C、E的氢化物稳定性顺序是 。(用化学式回答)
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)请写出B的单质的一种重要用途 ;工业上制取该单质的原理反应为 。
(5)请设计一个实验方案,使铜和A的最高价氧化物对应的水化物的稀溶液反应,得到蓝色溶液和氢气。请在方框内绘出该实验方案原理装置示意图。
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ. 将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ. 采用如下装置进行电化学浸出实验

将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并 加入少量催化剂。
Ⅲ. 一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ. 电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 阳极区硫酸铁的主要作用是 。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。
写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。(忽略电解前后溶液体积的变化)
在一定条件下可实现下图所示物质之间的转化:
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是______(填化学式)。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式: 。
(3)写出B电解生成E和D的反应方程式: 。
(4)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式 ,该反应消耗了2 molG,则转移的电子数是 。
试题篮
()