甲烷作为一种新能源在化工领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ;ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ;ΔH=﹣566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为: _____________________.
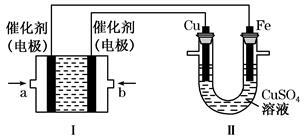
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①a处应通入_____(填“CH4”或“O2”),b处电极上发生的电极反应式是:
②电镀结束后,装置Ⅰ中溶液的pH值_____(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度 .
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH―以外还含有_____(忽略水解).
④在此过程中若完全反应,装置Ⅱ中阴极质量变化为12.8 g,则装置Ⅰ中理论上消耗甲烷_______L(标准状况下).
在1LK2SO4和CuSO4的混合溶液中,c(SO42-)="2.0" mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中K+的物质的量浓度为
| A.2.0 mol·L-1 |
| B.1.5 mol·L-1 |
| C.1.0 mol·L-1 |
| D.0.5 mol·L-1 |
将H2S通入FeCl3 溶液中,过滤后将反应液加入电解槽中电解(如下图所示)。电解后的溶液还可以循环利用。该方法可用于处理石油炼制过程中产生的H2S废气。下列有关说法正确的是
| A.过滤得到的沉淀可能是FeS和S |
| B.若有0.20mol的电子转移,一定能得到2.24L的氢气 |
| C.可以用Fe与外接电源的a极相连 |
| D.与a极相连的电极反应式为Fe2+-e-=Fe3+ |
用铂作电极电解一定浓度下列物质的水溶液,电解结束后,向剩余电解液中加适量水能使溶液和电解前相同的是
| A.CuSO4 | B.H2SO4 | C.CuCl2 | D.NaCl |
(1)某课外兴趣小组用下图装置进行实验,试回答:

①若开始时开关K与a连接,则A的电极反应式为_________。
②若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做_______。
③开关K与b连接,铁和石墨棒互换位置即可制得白色的较纯净Fe(OH)2沉淀,则铁电极反应式为_______。
(2)如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:

①电极A的名称是_______。
②甲装置中D电极的电极反应式:_______。
③在25℃时若用惰性电极电解饱和 NaCl溶液一段时间,当阳极产生5.6L(标准状况下)一种气体,电解后溶液体积为50L时,求所得溶液在25℃时的氢氧化钠物质的量浓度=_______。
④欲用丙装置给铜镀银,G应该是________(填“银”或“铜”),电镀液的主要成分是(填化学式)_______。
用铂电极电解100mLHNO3与AgNO3的混合液,通电一段时间后,两极均收集到2.24L气体(标况),则原混合液中Ag+的物质的量浓度为
| A.1mol/L | B.2mol/L | C.2.5mol/L | D.3mol/L |
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
| C.电解过程中,阳极质量的减少与阴极质量的增加不相等 |
| D.电解后,电解槽底部的阳极泥中只有Pt |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
| A.氢氧燃料电池在碱性介质中的负极反应式:H2-2e-=2H+ |
B.用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2C1-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
| D.钢铁发生吸氧腐蚀的负极反应式:Fe-2e-═Fe2+ |
如图是乙醇燃料电池的实验装置图,下列有关说法一定正确的是
| A.若用此装置给铁棒上镀上层银,则N电极改用铁电极,M电极改用银电极 |
| B.甲池中负极的电极反应式为:CH3CH2OH-12e-+3H2O=2CO2+12H+ |
| C.甲池KOH溶液中经过0.05mol电子时,理论上乙池中的M电极质量增加5.40g |
| D.M电极上的电极反应式为:Ag++e-=Ag |
(1)在25℃、101 kPa下,1 g甲烷完全燃烧后,恢复到原状态放热Q kJ,则表示甲烷燃烧热的热化学方程式为_________________ 。
(2)肼(N2H4)一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为 。
(3)如图装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为 (选填“变大”、“变小”、“不变”)。通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入 (填序号).
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |

(4)下图是用于笔记本电脑的甲醇(CH3OH)燃料电池结构示意图,质子交换膜左右两侧的溶液均为500mL 2 mol/LH2SO4 溶液,当电池中有1mol e-发生转移时,左右两侧溶液的质量之差为 (忽略气体的溶解,假设反应物完全耗尽)。

用惰性电极电解2L、1mol/L的CuSO4溶液,在电路中通过0.5mol电子后,调换正、负极,电路中又通过了1mol电子,此时溶液中H+的浓度(假设溶液体积不变)是
| A.1.5mol/L | B.0.75mol/L | C.0.5mol/L | D.0.25mol/L |
Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:

①燃料电池即电源的N极的电极反应式为 _______________________;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)  N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂 C.减小容器体积 D.扩大容器体积
用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,测得溶液pH变化如右图所示。
(1)在0→t1时间内,阳极上的电极反应式为:___________________________;
(2)用离子方程式表示:a点 pH﹥7原因:__________________________;0→t1时间内,溶液pH升高比较缓慢的原因:_______________________
(3)从原溶液中溶质变化角度看,t1时刻的意义是________________________
(4)有人利用电解原理开发出了一种家用“84”消毒液(有效成分为NaClO)发生器(构造如图),在制备该消毒液时,a电极应该连接在电源的________________极上,若两个电极一种是铁、一种是石墨,则b极材料是________________。
观察下列几个装置示意图,有关叙述正确的是
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③闭合电键后,外电路电子由a极流向b极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
试题篮
()