右图装置中,U 型 管内为红墨水,a、b 试管内分别盛有食盐水和稀盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是( )
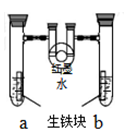
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe-2e-="==" Fe2+ |
| D.a 试管中发生了吸氧腐蚀,b 试管中发生了析氢腐蚀 |
下列关于金属腐蚀的说法中不正确的是
| A.金属腐蚀的本质是金属原子失去电子而被氧化 |
| B.金属腐蚀一般包括化学腐蚀和电化学腐蚀 |
| C.纯的金属一般难以发生电化学腐蚀 |
| D.钢铁在酸性环境中会发生吸氧腐蚀 |
下列有关金属腐蚀与防护的说法正确的是
| A.黄铜(铜锌合金)制作的铜锣易产生铜绿 |
| B.镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁中铁的腐蚀速率更快 |
| C.在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法 |
| D.不锈钢有较强的抗腐蚀能力是因为在钢铁表面上镀上了铬 |
下列化学实验事实及解释都正确的是
| A.向Na2S03溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2S03溶液已经变质 |
| B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
C.等体积、 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: |
D.向浓度均为0.1 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明 |
某小组为研究金属的腐蚀与防护,设计如图所示装置。下列叙述不正确的是( )
| A.若X为碳棒,为减缓铁的腐蚀,开关K应置于N处 |
| B.若X为碳棒,开关K置于M处,会加快铁的腐蚀 |
| C.若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法 |
| D.若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e-=Fe3+ |
下列叙述错误的是( )
| A.氢氧燃料电池是一种将化学能转化为电能的装置 |
| B.铁船舶的外壳上镶嵌锌块,可避免船体遭受腐蚀 |
| C.钢铁腐蚀时负极的电极反应式:Fe-3e-=Fe3+ |
| D.工业上电解饱和食盐水时阴极的电极反应式:2H++2e-=H2↑ |
下列叙述不正确的是
| A.金属的电化学腐蚀比化学腐蚀更普遍 |
| B.用铝质铆钉铆接铁板,铁板易被腐蚀 |
| C.钢铁在干燥空气中不易被腐蚀 |
| D.用牺牲锌块的方法来保护船身 |
下列说法正确的是
| A.马口铁(锡铁)镀层破损后被腐蚀时,首先是镀层被氧化 |
| B.原电池反应是导致金属腐蚀的主要原因,故不能用于减缓金属的腐蚀 |
| C.钢铁电化学腐蚀的两种主要类型其主要区别在于水膜的pH不同引起负极反应的不同 |
| D.无论哪种类型的金属腐蚀,其实质都是金属被氧化 |
一定条件下,碳钢腐蚀与溶液pH的关系如下表。下列说法不正确的是( )
| pH |
2 |
4 |
6 |
6.5 |
8 |
13.5 |
14 |
| 腐蚀快慢 |
较快 |
慢 |
较快 |
||||
| 主要产物 |
Fe2+ |
Fe3O4 |
Fe2O3 |
FeO2- |
A.当溶液pH<4,碳钢主要发生析氢腐蚀
B.当溶液pH>13.5,碳钢腐蚀的正极反应式为O2+4H++4e-=2H2O
C.当溶液pH>6,碳钢主要发生吸氧腐蚀
D.煮沸除去氧气的碱性溶液中,碳钢腐蚀速率会减缓
下列实验现象以及结论均合理的是
| A.在一块镀锡铁板刻一划痕,滴加酸化的食盐水浸泡及KSCN溶液,溶液颜色没有变化,判断其具有好的耐腐蚀性 |
| B.测定一定物质的量浓度的某NaA溶液的pH,pH>7,可以说明HA是弱酸 |
| C.在氯化银的悬浊液中加入碘化钠溶液,沉淀颜色不变,说明氯化银的溶解度比碘化银大 |
| D.在酸碱中和滴定中,用标准氢氧化钠溶液测定醋酸溶液的浓度时,用甲基橙做指示剂对滴定终点的判断比用酚酞的更准确 |
在日常生活中,我们经常看到铁制品生镑、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
| A.按图I装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 |
| B.图Ⅱ是图I所示装置的原理示意图,图Ⅱ的正极材料是铁 |
| C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl-—2e-—Cl2↑ |
| D.图Ⅲ装置的总反应为4A1+302+6H20——4A1(0H)3,生成的Al(OH)3进一步脱水形成白斑 |
化学与社会、生活密切相关。下列有关说法错误的是
| A.地球上99%以上的溴蕴藏在海洋中 |
| B.用食醋可除去热水壶内壁的水垢 |
| C.在水库铁闸门上接装铜块可减缓铁闸门腐蚀 |
| D.将煤气化或液化可减少污染、提高燃烧效率 |
在海轮的船壳上连接锌块,下列相关说法正确的是
| A.制成合金保护船体 | B.是外加电流的阴极保护法 |
| C.船体的反应:Fe -2e → Fe2+ | D.锌块的反应:Zn -2e → Zn2+ |
试题篮
()