某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
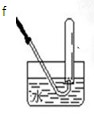
[实验1]铜与浓硫酸反应,实验装置如图所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
[实验2]实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图的实验:
(4)②中检验滤渣是否洗涤干净的实验方法是
(5)③中在煅烧过程中一定发生的反应的化学方程式为 。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项) 。
| A.固体甲中,CuS和Cu2S不能同时存在 |
| B.固体甲中,CuO和Cu2O至少有一种 |
| C.固体甲中若没有Cu2O,则一定有Cu2S |
| D.固体甲中若存在Cu2O,也可能有Cu2S |
玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。
下列有关实验过程中,一般不需要使用玻璃棒进行操作的是 ( )
①用pH试纸测定Na 2CO3溶液的pH
②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
③实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
④用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
⑤将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑦探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
| A.②③⑦ | B.③④⑤ | C.⑤⑥⑦ | D.④⑥⑦ |
已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
(1)B的结构简式是
(2)A可能属于下列哪类物质___________
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示):
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:  )
)
(4)甲的结构简式是 _________________。
由甲苯生成甲的反应类型是_________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是
(6)丙中官能团的名称是 。
(7)普鲁卡因有两种水解产物丁和戊。
① 戊与甲互为同分异构体,戊的结构简式是_____________________。
② 戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是 。
③ D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是________________________________。
草酸晶体(H2C2O4·2H2O) 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)
铁不能与冷水反应,但能与水蒸气反应,某化学兴趣小组为探究铁与水蒸气反应,请你为他们完成实验报告。
实验目的:探究铁与水蒸气的反应
反应原理: (用化学反应方程式表示)
实验装置:回答以下问题(加热装置略去)
| 装置编号 |
A |
B |
C |
D |
|
| 装置 |
 |
 |
 |
 |
|
| 装置所起作用 |
|
|
|
|
|
| 按加热先后从左至右,实验装置连接顺序和导管连接方法 |
装置连接顺序: (填装置编号) |
||||
| 需要加热的装置 |
(填装置编号) |
||||
实验装置改进:兴趣小组同学根据反应原理改进实验装置,得到相同的结论,如图所示:
问:试管底部是蘸有水的湿棉花,其作用是 ,蒸发皿内加入的肥皂液的作用 。
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。⑴提出假设 ①该反应的气体产物是CO2。②该反应的气体产物是CO。③该反应的气体产物是 。
⑵设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
⑶查阅资料
氮气不与碳、氧化铁
发生反应。实验室可
以用氯化铵饱和溶液和
亚硝酸钠(NaNO2)饱
和溶液混合加热反应制
得氮气。请写出该反应的离子方程式: 。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、0.48g碳粉混均匀,放入50.00g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为
。
⑸数据处理试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: 。zx
某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
| 实验用品 |
溶液温度 |
中和热 △H |
|||
| t1 |
t2 |
||||
| ① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
| ② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。△H=
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
(12分〉某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的KSP为 ,饱和亚硫酸中
,饱和亚硫酸中 。
。
(1) 将0.1 mol • L—1的BaCl2溶液滴入饱和亚硫酸中,_______ (填“能”或“不能”)生成BaSO3沉淀,原因是______________ (请写出必要的推断过程)。
(2) 浓硫酸的沸点为338°C,酒精灯火焰的温度为400〜5000C,甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
①写出加热试管中发生反应的化学方程式:_____________________
②白色沉淀的化学式是_______,请用离子方程式表示生成该白色沉淀的可能原因___________________________________
(3) 乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检验)。
①打开弹簧夹,通入N2—段时间后关闭弹簧夹
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
操作①的目的是_______,洗气瓶B中的试剂是______________。
(4) 丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色沉淀,丙滴加的试剂可能是______________。
| A.NaOH溶液 | B.Na[Al(OH)4]溶液 | C.H2O2溶液 | D.酸性 KMnO4溶液 |
下列过程中,没有明显实验现象的是( )
| A.向Fe(NO3)2溶液中滴加稀硫酸 | B.将HC1通入NaAlO2溶液中 |
| C.加热溶有SO2的品红溶液 | D.向碳酸氢钠溶液中滴加氢氧化钠溶液 |
下列实验方案合理的是
| A.鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟 |
| B.检验酒精中的少量水:向酒精中加入足量生石灰 |
| C.制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D.除去乙炔中杂质气体:将实验室制得的乙炔气体通入硫酸铜溶液 |
制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验利用了氨气的 性质。
(4)如果只提供如图2的装置,请说明引发喷泉的方法 。
亚铁是血红蛋白的重要组成部分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+34%~36%,是薄衣片,与VC(维生素C)同服可增加本品吸收。某同学设计实验对其中的铁成分进行了验证。请一起完成实验:
第一步:查阅资料得知,双氧水可以氧化SCN—生成N2、CO2、和SO42—,也可以将Fe2+氧化成 Fe3+。
第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色混浊液,说明有 存在(填离子符号)。
第三步:往上述溶液中滴入几滴KSCN溶液出现浅红色,说明溶液中有少量Fe3+存在。该离子存在的原因可能是(填序号):
①药品中的铁本来就以Fe3+的形式存在:②在制药过程中生成少量Fe3+;
②本实验过程中有少量Fe3+生成。
第四步:将第三步所得溶液分成两份,分别装在A、B两个试管中。
第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去。
红色变深的原因是(用离子方程式表示) 红色又逐渐褪去的原因可能是
设计实验证明你的推测
第六步:向B试管的溶液中加入一片VC,片刻后溶液红色也褪去,说明VC有 性。怎样理解药品说明书中所述“与VC(维生素C)同服可增加本品吸收”这句话?
。
.(16分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为________________________________________。
(2)装置A的烧瓶中可装试剂_______________________________________________。
(3)B装置的名称是________________________________________________________;
E装置的作用__________________________________________________________。
(4)通入C装置的两根导管左边较长、右边较短,目的是_________________________。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:_________________________________________________。
当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(用含a、b的代数式表示)_________________。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?____________________________________________________________________________。
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】① Mg2+检验方法:取2滴待检液,加入2滴2 mol·L-1 NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH会妨碍Mg2+检出。
② Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵。
③很多合金是金属互化物,有确定的化学组成。
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式。
【实验探究】
(1)甲同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。
由甲的实验记录可知,该焰火原料是由________和________两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是 。
(2)乙同学利用甲同学的结论,设计如下图所示的实验步骤,确定合金组成。
问题讨论:
①能确定合金组成的数据组有________。(填字母)
A. m、n B. m、y C. n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7 mol,试在下图中作出y随x变化的曲线。
③当y=8.5 mol时,该合金是一种金属互化物,其化学式为________________。
Mg能在CO2中燃烧,Na比Mg更活泼,那么Na能在CO2中燃烧吗?某研究性学习小组设计了如下装置进行探究。
(1)该装置B中饱和碳酸氢钠溶液的作用是 ,
装置C中浓硫酸的作用是 。
(2)从试剂瓶中取出的金属钠,必须经过必要的操作,方可进行后续的实验,该必要的操作是 。
(3)放进玻璃管中的金属钠在加热之前,必须先打开活塞, 通入CO2, 这样操作的原因是 。
(4)用酒精灯给玻璃管加热,Na在充满CO2气体的玻璃管里剧烈地燃烧,产生大量的白烟。玻璃管中有黑色物质生成。玻璃管冷却后,玻璃管壁上附着一层白色物质。将玻璃管内物质转移至烧杯中, 加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往滤液中加CaCl2溶液,溶液变白色浑浊;再滴入稀盐酸,溶液中有气泡出现,则玻璃管壁上附着的白色物质是 。另将滤纸上的黑色物质干燥,点燃,其燃烧产物无色无味且能使澄清石灰水变浑浊,则玻璃管中的黑色物质是 。
试题篮
()