美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下:
(1)甲酸还原氧化钯的化学方程式为 。
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是 (写化学式)。
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
①气体B的化学式为
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%。则A的化学式为 ;
(4)钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯的适宜条件是:反应温度为 ,反应时间约为 ,含钯的样品与王水的质量比为 。
(5)700℃“焙烧1”的目的是 , 550℃“焙烧2”的目的是 。
某研究性学习小组研究HNO3的氧化性,设计了如下实验:在盛有新配制FeS04溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴人几滴浓HN 03,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色突然变为蓝色,并产生红棕色气体。这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
(1)实验室粗略配制一定质量分数的硫酸亚铁溶液的方法是:将一定质量的绿矾(FeS04·7H2 0)置于烧杯中,__________________________。
(2)提出假设:
甲同学认为是FeS04与HN03作用
乙同学认为是KSCN与HNO3作用
(3)根据乙同学的观点,设计了如下实验方案进行验证:向浓HN03中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体。继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通人过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(该气体是空气中的主要成分之一);向反应后的溶液中加入BaC12溶液产生白色沉淀。
写出向浓HNO3中滴入KSCN溶液反应的离子方程式:__________________
丙同学认为还应设计K2S04溶液与浓硝酸作用的实验,他的理由是__________________
(4)延伸探究:丁同学认为SCN-的性质还应进一步探究,查资料发现:(SCN)2是一种“拟卤素”,与C12、Br2有相似的性质。他据此设计了以下方案:向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均变为黄色。请写出Fe(SCN)3与氯气反应的离子方程式: 。
(5)通过本次探究,可以得出以下结论:
a、用SCN -间接检验Fe2+时加入氧化剂应注意 (填“少量”、“过量”);
b、与SCN-反应使溶液变红的不一定是Fe3+
对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
①定性分析:如图甲可通过观察_________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_________________________。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是________________________。
现有以下实验装置供实验时挑选使用。
(1)利用Cu和浓硝酸反应制备NO2,用过氧化氢溶液和MnO2制取O2,根据反应原理应选用___________装置(填序号,从A、B、C中选取)。
(2)某同学设计下列四种制备NH3的方法,不合理的是_________(填序号)
(3)欲用石灰石和浓盐酸反应制取纯净干燥的CO2气体,将你所选的仪器按气体由左向右方向连接,连接顺序为______________→G→___________________。
用饱和碳酸氢钠溶液除去挥发出的HCl优于用水除HCl的原因是_____________________
____________________________________________________。
(4)某小组为了探究Ag与浓硝酸反应过程中可能产生NO,设计了一连接顺序为D→H→I→K的实验装置。
①检验这一装置气密性的方法是________________________________________________
__________________________________________________________________________,
②反应开始前通入N2的目的是______________________________________________,
③反应结束,若H瓶中溶液体积为100mL,从中取出25.00mL溶液以酚酞作指示剂,用0.1000mol·L—1NaOH溶液进行滴定,两次滴定用去NaOH溶液的体积分别为16.98mL和17.0.2mL,则该瓶中硝酸的物质的量浓度为_________________。
若实验测得NO的体积为95.2mL(已折算成标准状况),请你通过数据说明Ag与浓硝酸反应过程中是否有NO产生____________________________________________________
___________________________________________________________________________。
利用下图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):_________ __________________。
(2)倒入NaOH溶液的正确操作是:____________。 (从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1) /℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH =__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)___________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(9分)有一已磨成粉末的混合物试样,是由下列六种物质中的若干种等量组成:
NaCl 、 KCl 、 CaCl2、CuSO4( 无水)、 Na2SO4、Na2CO3
为了要确定该粉末试样的成分,某研究性学习小组先查了资料后,研拟了一个检验粉末试样的流程图,并在老师的指导下在化学实验室中进行实验。以下是该小组实验报告的一部分﹕
实验一:用烧杯取粉末试样约2克,加蒸馏水约100毫升,搅拌后形成无色的透明溶液X。
实验二:在溶液X中加了盐酸,观察到在溶液中陆续产生气泡,至溶液不再冒气泡,溶液仍为无色透明(贴上卷标Y)。
实验三:在无色透明的溶液Y中,滴加BaCl2溶液,即见白色沉淀。
实验四:继续滴加BaCl2溶液,至白色沉淀不再产生后,过滤分离出白色沉淀,得到透明的无色滤液Z。
实验五:在滤液Z中,滴入AgNO3溶液,则见白色沉淀,加入稀硝酸,沉淀不溶解。
(1)根据上述实验报告,原粉末中一定没有哪两种物质﹖ (填化学式)
(2)原粉末中,一定含有哪两种物质 ﹖ ( 填化学式)
(3)若只需回答上述(1)(2)的问题,你认为该小组同学不需要做哪两个实验 (填标号)
a、实验一 b、实验二 c、实验三 d、实验四 e、实验五
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)___ _______;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其都发生的反应的化学方程式为_____________ ___________;与实验Ⅲ相比,实验Ⅳ的优点是__________________________;
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________;
(4)有同学认为,除上述试验方法外,向两种固体配成的溶液中加入澄清石灰水也可以区分它们,这种说法是_____________(填“正确”或“错误”)的。
(5)将碳酸氢钠溶液与足量的澄清石灰水混合并充分反应,其离子方程式为_________________________。其剩余溶液的溶质化学式为___________
(6)另有两瓶溶液,已知分别是K2CO3和NaHCO3,请你写出两种不同的鉴别方法。
①________________________________________________________________________;
②_______________________________________________________________________。
(12分)正丁醛是一种化工原料。某实验小组利用如右装置合成正丁醛。发生的反应如下: 。反应物和产物的相关数据列表如下:
。反应物和产物的相关数据列表如下:
| |
沸点/℃ |
密度/g·cm-3 |
水中溶解性 |
| 正丁醇 |
117.2 |
0.8109 |
微溶 |
| 正丁醛 |
75.7 |
0.8017 |
微溶 |
实验步骤如下:
将Na2Cr2O7溶液与浓硫酸混合液放置在B中。在A中加入正丁醇和几粒沸石,加热,保持反应温度为90~95℃,在E中收集90℃以上的馏分。
将馏出物倒入分液漏斗中,除去水层,有机层干燥后蒸馏,收集75~77℃馏分。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由 。
(2)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(3)温度计的作用分别是C1 ;C2 。
(4)将正丁醛粗产品置于分液漏斗中水在 层(填“上”或“下”)。
(5)反应温度应保持在90~95℃,其原因是 。
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;
② 。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。

在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别是

| |
a(干燥气体) |
b(液体) |
| A |
NO2 |
水 |
| B |
CO2 |
水 |
| C |
Cl2 |
饱和食盐水 |
| D |
NH3 |
水 |
为探究铜丝在酒精灯火焰上灼烧后表面黑色固体的成分,设计如下过程:
(1)提出假设:黑色固体可能是C、______中的一种或两种。
(2)验证假设:灼烧后的铜丝插入足量稀硫酸中,若溶液变蓝,说明必有__________;若溶液中有黑色不溶物,说明必有__________
某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题。

(1)通Cl2一段时间后,A中观察到的现象是___________________,B中观察到的现象是___________________,由此可得出的结论是____ ___,写出有关反应的离子方程式:______________________________。
(2)C装置的作用是___________________,写出有关反应的离子方程式:_____________________
为探究一溴环己烷( )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是
| A.甲 | B.乙 |
| C.丙 | D.上述实验方案都不正确 |
(届四川省泸州市高三第一次诊断性考试化学试卷)
在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与化学反应)。某化学研究学习小组对硫铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置已省略)。A中的试剂是双氧水,将m·g该硫铁矿样品放人硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全。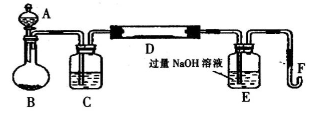
II.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
②在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
③将滤液B稀释为250 mL;
④取稀释液25.00 mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体
积的平均值为V mL。
请根据以上实验,回答下列问题:
(1)I中装置C中盛装的试剂是_ ;E瓶的作用是_ 。
(2)11中加入过量H2O2溶液发生反应的离子方程式为____。
(3)111的步骤③中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,
还必须要用到的是_ ;④中盛装KMnO3溶液的仪器是_ 。
(4)假设在整个实验过程中硫元素和铁元素都没有损失,则该硫铁矿样品中硫元素的质量分数为_ 。(用含m1和m2的代数式表示);铁元素的质量分数为____。(用含m1、c、v的代数式表示)
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 |
金属 质量/g |
金属 状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/S |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0. 8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
(1) 实验4和5表明_________对反应速率有影响;________,反应速率越快,能表明这一规律另一组实验是___________(填实验序号)。
(2) 在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有________(填实验序号)。
(3) 本实验中影响反应速率的其他因素还有_________,其实验序号是_____。
(4) 实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
_________________________________________________________。
试题篮
()