金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组用实验探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象如下:
| 金属[ |
Ti |
Mg |
Cu |
| 金属表面现象 |
放出气泡速度缓慢 |
放出气泡速度快 |
无变化 |
下列有关三种金属的说法正确的是
A.三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和稀盐酸不发生化学反应
化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。请回答下列问题
(1)装置A中盛放亚硫酸钠的仪器名称是_______,其中发生反应的化学方程式为________________。
(2)实验过程中,装置B、C中发生的现象分别是_____________、_____________,这些现象分别说明SO2具有的性质是_________和__________。
(3)尾气可采用__________溶液吸收。
(12分) 某同学设计如图所示装置分别进行探究实验(夹持装置已略去)

| 实验 |
药品 |
制取气体 |
量气管中的液体 |
| ① |
Cu、稀HNO3 |
|
H2O |
| ② |
NaOH固体、浓氨水 |
NH3 |
|
| ③ |
Na2CO3固体、稀H2SO4 |
CO2 |
|
| ④ |
镁铝合金、NaOH溶液(足量) |
H2 |
H2O |
请回答下列问题:
(1)简述如何检查该装置的气密性: 。
(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度。你认为是否可行?请简述原因 。
(3)实验②中剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有

(4)实验③中,量气管中的液体最好是 。
A.H2O B.CCl4
C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,② ,③视线与凹液面最低处相平。
(6)实验④获得以下数据(所有气体体积均已换算成标准状况)
| 编号 |
镁铝合金质量 |
量气管第一次读数 |
量气管第二次读数 |
| ① |
1.0g |
10.0mL |
346.3mL |
| ② |
1.0g |
10.0mL |
335.0mL |
| ③ |
1.0g |
10.0mL |
345.7mL |
根据上述合理数据计算镁铝合金中铝的质量分数 。
己二酸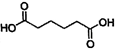 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
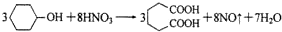
可能用到的有关数据如下:
| 物质 |
密度(g/cm3) |
熔点 |
沸点 |
溶解性 |
相对分子质量 |
| 环己醇 |
0.962g/cm3 |
25.9℃ |
160.8℃ |
20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
100 |
| 己二酸 |
1.360g/cm3 |
152℃ |
337.5℃ |
在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
146 |
实验步骤如下:
Ⅰ、在三口烧瓶中加入16mL 50%的硝酸(密度为l.3lg/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇。
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
Ⅲ、当环己醇全部加入后,将混合物用80℃-90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
Ⅴ、粗产品经提纯后称重为5.7g。
请回答下列问题:
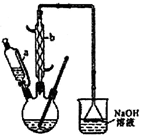
(1)滴液漏斗的细支管a的作用是________,仪器b的名称为________。
(2)己知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH =2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:________、________
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则可能造成较严重的后果,试列举一条可能产生的后果:__________,
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和________洗涤晶体。
(5)粗产品可用________法提纯(填实验操作名称)。本实验所得到的己二酸产率为________。
某同学用下列装置验证一些物质的性质。下列说法错误的是
| A.Ⅰ图中:将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升 |
| B.Ⅱ图中:观察到湿润的有色布条能褪色,待尾气全部被碱吸收后,将稀硫酸滴入烧杯中,至溶液显酸性,可能看到有黄绿色气体生成 |
| C.Ⅲ图中:观察到量筒内黄绿色逐渐消失,量筒内壁有油状物质生成。该现象是由于甲烷与氯气在光照条件下发生了加成反应 |
D.Ⅳ图中,可以比较 、 、 和S氧化性的相对强弱 和S氧化性的相对强弱 |
利用下图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):_________ __________________。
(2)倒入NaOH溶液的正确操作是:____________。 (从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1) /℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH =__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)___________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
某学习小组为探究维生素C的组成和有关性质,进行了以下实验:取维生素C样品研碎,称取该试样0.704 g,置于铂舟并放人燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,样品逐渐消失最后无任何残留物,将生成物(仅有两种物质)先后通过无水CaCl2和碱石灰,两者分别增重0.288 g和1.056 g,生成物完全被吸收。
请解答下列问题:
(1)称取的试样中,含有氢原子的物质的量是 mo1;碳元素的质最是 g。
(2)维生素C中 (填“含”、“不含”或“无法确定是否”)有氧元素,理由是根据实验数据可知 。如你回答“含”有,请计算称取的试样中氧原子的物质的量并填入下一空格中;如你回答“不含”等,则下一空格不必填写。称取试样中氧原子的物质的量为 mol。
(3)如果要确定维生素C的分子式,你认为还需要知道的信息是 。
某研究小组通过实验探究金属及其化合物的性质,操作正确且能达到目的的是
| A.将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 |
| B.向煮沸的1mol/LNaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D.将表面有铜绿[Cu2(OH)2C03]的铜器放入盐酸中浸泡,除去铜绿 |
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是:________,该装置中发生反应的化学方程式为________________________。
(2)实验过程中,装置乙、丙中出现的现象分别是________ ;_____________ 装置丙中的试管内发生反应的离子方程式为_______ 。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体;通入的这种气体的名称是________。
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;
② 。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。

在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别是

| |
a(干燥气体) |
b(液体) |
| A |
NO2 |
水 |
| B |
CO2 |
水 |
| C |
Cl2 |
饱和食盐水 |
| D |
NH3 |
水 |
为探究铜丝在酒精灯火焰上灼烧后表面黑色固体的成分,设计如下过程:
(1)提出假设:黑色固体可能是C、______中的一种或两种。
(2)验证假设:灼烧后的铜丝插入足量稀硫酸中,若溶液变蓝,说明必有__________;若溶液中有黑色不溶物,说明必有__________
某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题。

(1)通Cl2一段时间后,A中观察到的现象是___________________,B中观察到的现象是___________________,由此可得出的结论是____ ___,写出有关反应的离子方程式:______________________________。
(2)C装置的作用是___________________,写出有关反应的离子方程式:_____________________
在研究金属钠与水反应的实验中,下列根据实验现象得出的结论不正确的是
| A.将一小块Na投入水中,钠浮于水面,说明钠密度比水小 |
| B.将一小块Na投入滴有酚酞的水中,溶液变红,说明反应生成了碱 |
| C.将一小块Na投入CuSO4溶液中,生成蓝色沉淀,说明Na没有Cu活泼 |
| D.点燃Na与肥皂水反应产生的气泡,有尖锐爆鸣声,说明有H2生成 |
试题篮
()