下列叙述I和II均正确并有因果关系的是
| 选项 |
叙述I |
叙述II |
| A |
KNO3的溶解度大 |
用重结晶法除去KNO3中混有的NaCl |
| B |
BaSO4难溶于酸 |
用盐酸和BaCl2溶液检验SO42- |
| C |
NH3能使酚酞溶液变红 |
NH3可用于设计喷泉实验 |
| D |
Ca(OH)2能制成澄清石灰水 |
可配制2.0 mol∙L-1的Ca(OH)2溶液 |
某化学研究性学习小组对电解质溶液作出如下的归纳总结(均在常温下),其中正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa、b.C6H5ONa、c.NaHCO3、d.NaOH。其溶液物质的量浓度由小到大的顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
| A.③④⑥ | B.③⑤⑥ | C.④⑤⑥ | D.①②④ |
在探究FeCl3溶液的实验中,下列根据实验现象得出的结论不正确的是
| A.向溶液中加入KSCN溶液,溶液变血红色,证明溶液中含有Fe3+ |
| B.向溶液中加入NaHCO3固体,有气泡产生,说明溶液中含有H+ |
| C.当一束光通过溶液时从侧面发现一道光束,说明Fe3+水解产生胶体 |
| D.向溶液中加入金属锌,锌逐渐溶解溶液出现红褐色浑浊,说明铁被置换出来 |
有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。
对此实验下述结论正确的是
| A.Na2SO3已部分被空气中的氧气氧化 |
| B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 |
| C.此实验不能确定Na2SO3是否部分被氧化 |
| D.加硝酸后的不溶沉淀一定是BaSO3 |
下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述不正确的是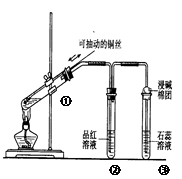
| A.装置①能控制反应的发生和结束 |
| B.若将反应后②的试管取下,在通风橱中加热,会产生刺激性气味的气体,溶液呈红色 |
| C.③中石蕊溶液变红色 |
| D.为确认CuSO4生成,向①中加水,观察溶液颜色 |
下表中是各组反应的反应物和温度,反应刚开始时,放出H2速率最快的是( )
| 编号 金属(粉末状) 酸的浓度及体积 反应温度 (mol) (℃) |
| A Mg,0.1 6 mol·L-1硝酸10mL 80 B Mg,0.1 3 mol·L-1盐酸10mL 60 C Fe,0.1 3 mol·L-1L 盐酸10mL 60 D Mg,0.1 3 mol·L-1硫酸10mL 60 |
下列实验方法操作,能达到要求的是( )
| A.用托盘天平称量25.20g氯化钠固体 |
| B.用250ml容量瓶配制150mL一定浓度的盐酸溶液 |
| C.用一束强光照射经过煮沸的三氯化铁溶液有光亮的通路,说明已生成氢氧化铁胶体 |
| D.过量的铁丝在氯气中点燃,可制取氯化亚铁 |
一元硬币的外观有银白色的金属光泽,一些同学推测它可能是铁制成的。在讨论时,有同学提出:“我们可以先拿磁铁来吸一下。”就这一过程而言,属于科学探究中的( )
| A.观察 | B.实 验 验 |
C.分类 | D.比较 |
在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是
①滴有石蕊的NH4Cl溶液 ②滴有石蕊的CO2溶液
③滴有石蕊的H2SO4溶液 ④滴有酚酞的氨水溶液
⑤滴有酚酞的氢氧化钠溶液 ⑥滴有酚酞的饱和氢氧化钙溶液
⑦滴有酚酞的Na2CO3溶液 ⑧溶有SO2的品红溶液
| A.②④ | B.①③⑤⑦ | C.①④⑥⑧ | D.②④⑥ |
下图是一种试验某种气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶盛的溶液是
| A.浓硫酸 | B.饱和食盐水 |
| C.浓氢氧化钠溶液 | D.氢氧化钙悬浊液 |
有下列物质:① NaOH固体;② 浓硫酸;③ NH4NO3晶体;④ CaO固体。现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如右图所示状态,判断加入的物质可能是
| A.① ② ③ ④ | B.① ② ④ |
| C.② ③ ④ | D.① ② ③ |
下列装置、操作及说法正确的是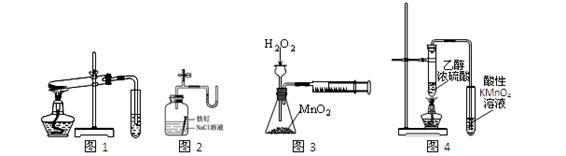
| A.图1探究NaHCO3的热稳定性 |
| B.图2证明铁生锈与空气有关 |
| C.图3定量测定H2O2的分解速率 |
| D.图4不能证明CH3CH2OH发生消去反应生成了乙烯 |
研究物质的性质的基本程序一般可分为四个步骤,研究物质的性质的一般程序的第二步是
| A.实验和观察 | B.预测物质的性质 |
| C.解释及结论 | D.观察物质的外观性质 |
相关实验不能表达预期目的的是 ( )
| |
相关实验 |
预期目的 |
| A |
把等质量的两份同种大理石块中的一份研成粉末,在同温度下分别与等体积同浓度的盐酸反应,观察放出气体快慢。 |
验证接触面积对化学反应速率的影响。 |
| B |
把装有颜色相同的NO2与N2O4混合气体的小试管(密封)分别浸入热水和冷水中,观察试管中气体颜色变化。 |
验证温度对化学平衡的影响。 |
| C |
直接将表面积相同的铝条和镁条投入同温度滴有酚酞的热水中,观察产生气泡的速率及溶液的颜色变化。 |
比较同周期金属元素的金属性强弱。 |
| D |
将足量氯水分别滴入盛有溴化钠溶液和氯化钠溶液的试管中,观察溶液颜色变化。 |
验证溴元素和碘元素的非金属性强弱。 |
试题篮
()