下列叙述I和II均正确并有因果关系的是
| 选项 |
叙述I |
叙述II |
| A |
KNO3的溶解度大 |
用重结晶法除去KNO3中混有的NaCl |
| B |
BaSO4难溶于酸 |
用盐酸和BaCl2溶液检验SO42- |
| C |
NH3能使酚酞溶液变红 |
NH3可用于设计喷泉实验 |
| D |
Ca(OH)2能制成澄清石灰水 |
可配制2.0 mol∙L-1的Ca(OH)2溶液 |
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别是

| |
a(干燥气体) |
b(液体) |
| A |
NO2 |
水 |
| B |
CO2 |
水 |
| C |
Cl2 |
饱和食盐水 |
| D |
NH3 |
水 |
某研究小组通过实验探究金属及其化合物的性质,操作正确且能达到目的的是
| A.将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 |
| B.向煮沸的1mol/LNaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D.将表面有铜绿[Cu2(OH)2C03]的铜器放入盐酸中浸泡,除去铜绿 |
实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )
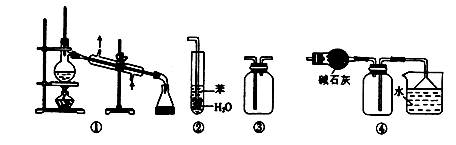
| A.装置①常用于分离互不相溶的液体混合物 |
| B.装置②可用于吸收NH3或HCl气体,并防止倒吸 |
| C.装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
某同学用下列实验装置探究硝酸的性质。根据图示判断下列结论不正确的是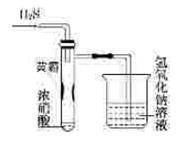
| A.试管内壁上“黄霜”的成分是硫 |
| B.该实验探究说明浓硝酸既有氧化性,又有挥发性 |
| C.烧杯内的NaOH溶液的作用是除去尾气,防止尾气污染环境 |
| D.H2S用SO2代替,将无明显反应现象 |
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
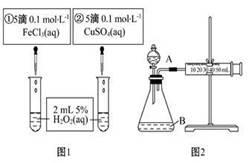
| A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间 |
| D.为检查图2装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原 |
某化学研究性学习小组对电解质溶液作出如下的归纳总结(均在常温下),其中正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa、b.C6H5ONa、c.NaHCO3、d.NaOH。其溶液物质的量浓度由小到大的顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
| A.③④⑥ | B.③⑤⑥ | C.④⑤⑥ | D.①②④ |
某溶液中含K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-中的若干种,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰。
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成。
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色。下列说法正确的是
| A.原溶液中肯定不含Fe2+、NO3-、SiO32-、I- |
| B.原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- |
| C.步骤Ⅱ中无色气体是NO气体,无CO2气体产生 |
| D.为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
下列实验现象对应的结论正确的是

气密性检查 ②气体性质检验 ③化学平衡的探究 ④喷泉实验
| 选项 |
现象 |
结论 |
| A |
①中导管口冒气泡,手松开无现象 |
气密性良好 |
| B |
②中KMnO4溶液紫红色褪去 |
SO2具有漂白性 |
| C |
③中关闭K,气体颜色在热水中比冷水深 |
NO2生成N2O4为吸热反应 |
| D |
④中烧瓶中形成喷泉 |
Cl2易溶于CCl4 |
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含Cl2的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③Na2SO3溶液 ④饱和FeBr2溶液
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组用实验探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象如下:
| 金属[ |
Ti |
Mg |
Cu |
| 金属表面现象 |
放出气泡速度缓慢 |
放出气泡速度快 |
无变化 |
下列有关三种金属的说法正确的是
A.三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和稀盐酸不发生化学反应
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
| A.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 |
| B.Y可以是葡萄糖溶液 |
| C.相对于途径①,途径②更好地体现了绿色化学思想 |
| D.将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体 |
某同学用下列装置验证一些物质的性质。下列说法错误的是
| A.Ⅰ图中:将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升 |
| B.Ⅱ图中:观察到湿润的有色布条能褪色,待尾气全部被碱吸收后,将稀硫酸滴入烧杯中,至溶液显酸性,可能看到有黄绿色气体生成 |
| C.Ⅲ图中:观察到量筒内黄绿色逐渐消失,量筒内壁有油状物质生成。该现象是由于甲烷与氯气在光照条件下发生了加成反应 |
D.Ⅳ图中,可以比较 、 、 和S氧化性的相对强弱 和S氧化性的相对强弱 |
下列实验不能获得成功的是
| |
实验目的 |
实验步骤 |
| A. |
探究催化剂对化学反应速率的影响 |
向H2O2溶液中滴加少量FeCl3溶液 |
| B. |
探究乙醇能发生氧化反应 |
将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C. |
探究石蜡油分解的产物不都是烷烃 |
将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D. |
探究蔗糖水解的产物中是否含有葡萄糖 |
取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热 |
试题篮
()