Ⅰ.硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有 。
| A.NaOH溶液 | B.酸性KMnO4溶液 | C.澄清石灰水 | D.盐酸 |
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。
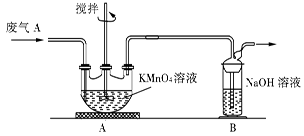
①为了保证实验成功,装置A应具有的现象是 ,搅拌的目的是 。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是 。
Ⅱ.溴酸钾具有毒性,是一种常用的分析试剂和氧化剂,实验室中制备过程如下:
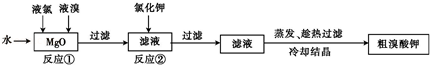
已知反应②是复分解反应,根据上述转化关系回答下列问题:
(1)反应①的化学方程式为 .
(2)反应②的化学方程式为 .
(3)现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示.请回答下列问题:
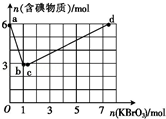
①已知b点时,KI反应完全,转移的电子数为 .
②b→c过程中,仅有一种元素的化合价发生了变化.则反应时氧化剂与还原剂的物质的量之比为 .
③d点时,n(KBrO3)为 .
(14)铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
查阅资料得知:
①常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
②常温下,Ksp[Cr(OH)3]=6.3×10-31
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝 热反应制取金属铬的化学方程式 。
(2)酸化滤液D时,不选用盐酸的原因是 。
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 。
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:
①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
| A.FeSO4溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.Na2SO3溶液 |
③调整溶液的pH=5时,通过列式计算说明溶液中的Cr3+是否沉淀完全 ;
④上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
草酸亚铁和草酸铁常用作照相显影剂或制药工业。I.某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·2H2O)分解产物的实验探究。他们设计了如下装置进行实验(夹持装置未画出),干燥管B、G中装有无水氯化钙,试管D、F、I中盛有澄清石灰水。
(1)烧瓶A中盛有饱和NH4C1和饱和NaNO2的混合液,常用于实验室制N2,则该反应的化学方程式为_____________________________。
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是___________________。
(3)①试管D中出现浑浊,证明分解产物中有____________存在。
②证明分解产物中存在CO的现象是______________________________。
③要证明分解时产生的另一种气态产物的存在,应该如何改进装置______________。
④将C中充分反心后的固体残余物投入经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为_____________(填化学式)。
II.三氯化铁是合成草酸铁的重要原料。已知草酸铁晶体在低温时溶解度较小。
(4)利用工业FeCl3(含杂质)制取纯净的草酸铁晶体【Fe2(C2O4)3·5H2O】的实验流程如下图所示:
①溶液X为浓盐酸,目的是_________________。
②上述流程中FeCl3可用异内醚萃取,其原因是__________________。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是___________________。
④为测定所得草酸铁晶体的纯度,实验室中用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于__________(填“酸式”或“碱式”)滴定管中。
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁。实验室中利用下图所示装置探究由废铁屑制备FeCl3·6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应)。
(1)装置A的名称为 。
(2)检验该装置气密性的具体操作如下:
①关闭 ;打开弹簧夹K1;
②向水准管中加水,使水准管液面高于量气管液面;
③ 。
取m g废铁屑加入B装置中,在A中加入足量的盐酸后进行下列操作:
Ⅰ.打开弹簧夹K1,关闭活塞b,打开活塞a,缓慢滴加盐酸。
Ⅱ.当装置D的量气管一侧液面不再下降时,关闭弹簧夹K1,打开活塞b,当A中溶液完全进入烧杯后关闭活塞a、b。
Ⅲ.将烧杯中的溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(3)用离子方程式表示烧杯中足量的H2O2溶液的作用: 。
(4)实验结束后,量气管和水准管内液面高度如上图所示,为了使两者液面相平,应将水准管 (填“上移”或“下移”)。
(5)由FeCl3溶液制得FeCl3•6H2O晶体的操作过程中不需要使用的仪器有 (填选项序号)。
a.蒸发皿
b.烧杯
c.酒精灯
d.分液漏斗
e.坩埚
f.玻璃棒
g.漏斗
(6)实验结束后,若量气管内共收集到VmL气体(已换算成标准状况),则此废铁屑中铁单质的质量分数为 。
SO2是常见的大气污染物,燃煤是产生SO2的主要原因。工业上有多种方法可以减少SO2的排放。
(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙。该反应的总化学方程式是___________________________________。
(2)可用多种溶液做燃煤烟气中SO2的吸收液。
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHS03时,两种吸收液体积比V(Na2SO3): V(NaOH)= 。
②NaOH溶液吸收了足量的:SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是 。
(3)甲同学认为BaCl2溶液可以做SO2的吸收液。为此甲同学设计如下实验(夹持装置和加热装置略,气密性已检验)。反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀。甲同学认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2溶液可做SO2吸收液。
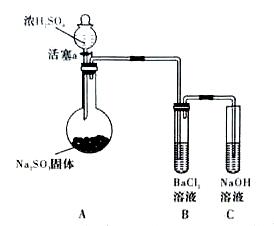
乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:
①A中产生的白雾是浓硫酸的酸雾,进入B中与BaCI2溶液反应生成BaSO4沉淀。
② 。
为证明SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
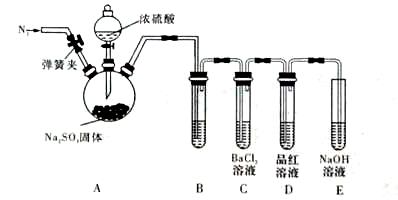
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现象;D中红色褪去。
③试管B中试剂是 溶液;滴加浓硫酸之前的操作是 。
④通过甲、乙两位同学的实验,得出的结论是 。
某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应。他们设计了下图装置(夹持装置已略去,装置的气密性良好)进行实验,探究SO2与Na2O2反应的产物,请按要求回答下列问题。
Ⅰ﹒写出装置A中发生反应的化学方程式:___________________________
Ⅱ﹒装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以_____________
Ⅲ﹒在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;
假设2:_________;
假设3:既有Na2SO3,又有Na2SO4。
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:________________
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:
甲同学由此得出结论:产物是Na2SO4,该方案是否合理______(填“是”或“否”),理由是_____________
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表。
| 实验步骤 |
现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解。 |
固体全部溶解 |
| ②向上试管中加入过量的_____________,将产生的气体通入少量酸性KMnO4溶液中。 |
KMnO4溶液__________ |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液。 |
产生白色沉淀 |
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为:__________
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。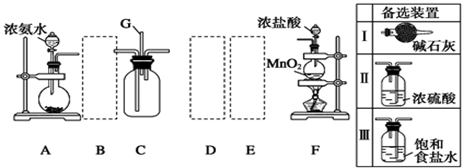
请回答下列问题:
(1)装置F中发生反应的离子方程式:________________________________________。
(2)装置A中的烧瓶内固体可选用_________(选填以下选项的代号)。
A.碱石灰
B.生石灰
C.二氧化硅
D.五氧化二磷
E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B ,D___________,E 。(均填编号)
(4)通入C装置的两根导管左边较长、右边较短,目的是__ 。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:___ ;其中氧化剂与还原剂的物质的量之比为 ;当a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为 mol-1(用含a、b的代数式表示);
(6)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理? 。
某学生探究AgCl、Ag2S沉淀转化的原因。
| 步 骤 |
现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 |
产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 |
沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 |
较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是 。
(2)Ⅱ中能说明沉淀变黑的的离子方程式是 ,沉淀转化的主要原因是 。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是 。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀______。
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
| 现 象 |
B:一段时间后,出现乳白色沉淀 |
| C:一段时间后,无明显变化 |
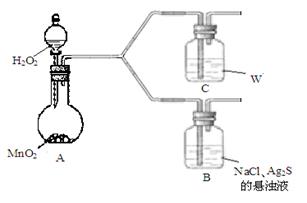
①A中产生的气体是_________。
②C中盛放的物质W是_________。
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S +  +
+  + 2H2O
+ 2H2O  4AgCl +
4AgCl +  + 4NaOH
+ 4NaOH
④B中NaCl的作用是_______。
某兴趣小组依据CO2+2Mg=2MgO+C,推测Mg与SO2在隔绝空气条件下反应后,剩余固体M可能含有MgO、S、MgS、Mg中的一种或几种。为了验证推测,进行以下实验。请回答有关问题。
实验Ⅰ 按下图所示进行实验。
(1)实验前需除去镁条表面氧化膜。用简易的物理方法除氧化膜的操作是 ;
(2)实验室制取二氧化硫的化学方程式为 ;
(3)上述装置存在不合理之处,请提出1项改进建议 ;
(4)实验时,先通入SO2直到 现象出现后,再点燃酒精灯;此操作目的是 。
实验Ⅱ 确定固体M的成分。
实验装置如图所示。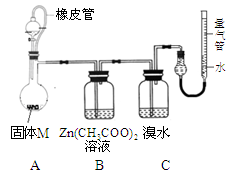
将分液漏斗中稀硫酸(足量)
加入到烧瓶中,完全反应后,实验现象如下:
| 装置 |
A |
B |
C |
量气管 |
| 现象 |
有残留 固体 |
产生白色ZnS沉淀 |
溴水 未褪色 |
进入气体 v mL(标况) |
(5)实验时,B装置中反应的化学方程式为 ;
(6)已知镁的相对原子质量为24,则固体M中金属镁的质量为 g;实验前装置内有空气,对金属镁质量的测定结果的影响是 (填偏低、偏高、无影响);
(7)依以上实验,可确定固体M的成分有 种(填数字)。
下图是丁烷裂解的实验流程:(提示:丁烷在一定条件下裂解的可能方程式为:
C4H10 C2H6+C2H4, C4H10
C2H6+C2H4, C4H10  CH4+C3H6)
CH4+C3H6)
连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等…‥
(1)这三步操作的先后顺序依次是 ;
(2)简要说明排空气的方法______________。
(3)写出甲烷与氧化铜反应的化学方程式
(4)若对E装置中的混合物(溴水足量),再按以下流程实验:
①分离操作Ⅰ和Ⅱ的名称分别是:Ⅰ______Ⅱ______,Na2SO3溶液的作用是(用离子方程式表示) .
②已知B的碳原子数大于A的碳原子数请写出B的结构简式 .
(5)假定丁烷完全裂解当(E+F)装置的总质量比反应前增加了0.7 g, G装置的质量减少了1.76 g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比n (CH4) : n (C2H6) =______(假定流经D、G装置中的气体能完全反应)
某校化学课外研究小组为研究浓硫酸与金属M 反应的气体生成物,进行了下列实验活动:
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3: 。
【实验验证】
实验装置及实验中使用的试剂如图:

(1)在装入药品前,甲同学检查装置A 的气密性,方法是 。
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设 ,理由是 。
(3)如果实验中观察到装置B 中溶液褪色,装置F 和装置G 中无明显变化,则假设 成立,实验测得消耗金属M 和浓硫酸的物质的量之比为1∶2,则在M 的硫酸盐中,M 元素的化合价为 。
(4)如果假设3 正确,填写下表中的实验现象:

(5)装置C 的作用是 ,装置D 的作用是 。
(6)如果装置A 中放入的金属M 的质量为11.2 g,加入适量浓硫酸,反应完成后,装置B中溶液褪色,装置A 中金属无剩余;反应后G 的质量增加了0.9 g;取少量装置A 中溶液稀释,分为两份,一份滴加KSCN 溶液,溶液变红色,另一份滴加酸性KMnO4溶液,溶液褪色。如果装置A 中溶液内的金属离子浓度相等,则装置A 中烧瓶内发生反应的总化学方程式是 。
某化学兴趣小组进行有关电解食盐水的探究实验,电解装置如图所示。

实验一:电解饱和食盐水。
(1)配制饱和食盐水所需的玻璃仪器有:烧杯、量筒、 。
(2)电解饱和食盐水的化学方程式为 。
实验二:电解不饱和食盐水及产物分析。
相同条件下,电解1mol·L-1 NaCl溶液并收集两极产生的气体。在X处收集到V1mL气体,同时,在Y处收集到V2mL气体,停止电解。结果发现V2<V1,且与电解饱和食盐水相比,Y处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:
ⅰ.有部分Cl2溶于NaCl溶液中;ⅱ.有O2生成。
(3)设计实验证明有部分Cl2溶于NaCl溶液中。实验方案为:取少量 电极附近溶液。
(4)证明有O2生成并测定O2的体积。按如右图所示装置进行实验,通过注射器缓缓地将在Y处收集到V2mL气体全部推入装置A(盛有足量试剂NaOH溶液)中,最终,量气管中收集到V3mL气体(设V1、V2、V3均在相同条件下测得)。

①装置A的作用是 。
②本实验中,观察到________________的现象,说明石墨电极上有O2生成。
③实验中是否需要预先除尽装置中的空气? (填“是”或“否”)。
(5)实验二中,在石墨电极上产生的Cl2的总体积为 mL(用代数式表示)。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:甲同学利用Al、Fe、Mg和2 mol/L的稀硫酸,设计实验方案研究影响反应速率的因素。
研究的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg |
反应快慢:Mg>Al>Fe |
反应物的性质越活泼,反应速率越快 |
(1)该同学的实验目的是_______________________;要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5 mol/L及2 mol/L的足量稀H2SO4反应,通过________可以说明浓度对化学反应速率的影响。

实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2983.2 kJ·mol-1①
P(s,红磷)+5/4O2(g)="==1/4" P4O10(s) ΔH2=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为 。相同状况下,能量状态较低的是________;白磷的稳定性比红磷________(填“高”或“低”)。)
草酸亚铁晶体的化学式为FeC2O4·2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4·2H2O FeO +CO2↑+CO↑+H2O
FeO +CO2↑+CO↑+H2O
(1)请你用下图中提供的仪器(可以重复选用,但每种仪器至少选用一次),选择必要的试剂[供选择的试剂:NaOH溶液、澄清石灰水、饱和碳酸钠溶液、CuO、无水硫酸铜、酸性高锰酸钾溶液],设计一个实验,检验FeC2O4·2H2O加热时分解产生的气态产物(包括水蒸气)(部分加热装置和夹持仪器在图中略去)。在答题卡上填写下表(可以不用填满,也可以补充)。
| 仪器符号 |
仪器中所加物质 |
作用 |
| A |
草酸亚铁晶体 |
加热草酸亚铁晶体得到气体产物 |
| |
|
|
| |
|
|
| D |
NaOH溶液 |
|
| |
|
|
| |
|
|
| |
|
|
| |
|
|
(2)按照题目提供的装置和要求设计的实验明显存在的一个不足是 。
(3)反应结束后,在A装置试管中有黑色固体粉末(混合物)产生,倒出时存在燃烧现象,产生上述现象的可能原因是 。
实验小组为探究SO2的漂白性和还原性,设计了以下实验。
完成下列填空:
(1).实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用 (选填编号),其理由是 。
a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
І.漂白性
(2).用如图所示装置(气密性良好)进行实 验,观察到如下现象:ⅰ中红色褪去、

ⅱ中无变化。
①足量碱石灰的作用是 。
②从实验中可知使品红的水溶液褪色的 微粒可能是 。
(3).实验小组进一步实验如下:取等量相同浓度
的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO3–或SO32–。你认为这一结论是否正确 ,理由是 。
ІІ.还原性
(4).将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是 ,如何检验该反应所得含氧酸根离子 。
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32–。
则②中红棕色变为浅绿色的原因是 。
试题篮
()