我国规定饮用水的硬度不能超过25度。硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量。通常把1升水中含有10mg CaO称为1度。某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
实验中涉及的部分反应:M2+(金属离子)+EBT(铬黑T) =M EBT
蓝色 酒红色
M2+(金属离子)+Y4-(EDTA) = MY2-
MEBT+Y4-(EDTA) = MY2-+EBT(铬黑T)
⑴取地下水样品25.0毫升进行预处理。已知水中由Ca2+、Mg2+和HCO3-所引起的硬度称为暂时硬度,可通过加热减小硬度,写出加热时所发生的化学反应(任写一个) ▲ 。预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是 ▲ 。
⑵将处理后的水样转移到250 mL的锥形瓶中,加入氨水-氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.0100 mol·L-1的EDTA标准溶液进行滴定,滴定时眼睛应 ▲ ,滴定终点时的实验现象是 ▲ 。
⑶滴定终点时共消耗EDTA溶液15.0 mL,则该地下水的硬度= ▲ 。
⑷若实验时装有EDTA标准液的滴定管只用蒸馏水润洗而未用标准液润洗,则测定结果将 ▲ (填“偏大”、“偏小”或“无影响”)。
水中氧的含量测定步骤如下:
步骤1:水中的氧在碱性溶液中将Mn2+氧化为MnO(OH)2。
步骤2:加入碘离子将生成的MnO(OH)2再还原成Mn2+离子。
步骤3:用硫代硫酸钠标准溶液滴定步骤2中生成的碘。
有关的测定数据如下:
1:Na2S2O3溶液的标定。取25.00 mL KIO3标准溶液(KIO3浓度:174.8 mg·L-1)与过量KI在酸性介质中反应,用Na2S2O3溶液滴定,消耗12.45 mL。
2:取20.0°C下新鲜水样103.5mL,按上述测定步骤滴定,消耗Na2S2O3标准溶液11.80 mL。已知该温度下水的饱和O2含量为9.08 mg·L-1。
3.在20.0°C下密闭放置5天的水样102.2 mL,按上述测定步骤滴定,消耗硫代硫酸钠标准溶液6.75 mL。
5-1 写出上面3步所涉及的化学反应方程式。
5-2 计算标准溶液的浓度(单位mol·L-1)。
5-3 计算新鲜水样中氧的含量(单位mg·L-1)。
5-4 计算陈放水样中氧的含量(单位mg·L-1)。
5-5 以上测定结果说明水样具有什么性质?
将固体MnC2O4·2H2O放在一个可以称出质量的容器里加热,固体质量随温度变化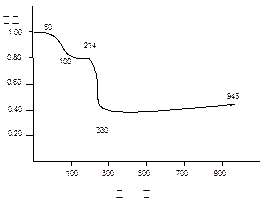
的关系如图所示(相对原子质量:H 1.0, C 12.0, O 16.0, Mn 55.0 ):
纵坐标是固体的相对质量。
说出在下列五个温度区间各发生什么变化,并简述理由:
0~50℃;50~100℃;100~214℃;214~280℃;280~943℃
Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
(1)A中发生的化学反应方程式为 。
(2)C中所盛试剂可能是 ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是 。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是 ;该生用如下实验进一步验证黑色物质的组成:
基于上述假设分析,黑色物质的组成为 (填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-) 
①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式 ;
②以淀粉为指示剂,则到达滴定终点的现象是 ;
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为 。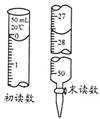
试题篮
()