某化学小组欲探究FeCl3溶液、FeCl2溶液的化学性质
(1)试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液。
查阅资料得知:淀粉遇I2变蓝。
请帮助他们完成以下实验报告:
| 序号 |
实验 目的 |
实验内容 |
实验现象 |
实验结论 |
离子方程式 |
| 实验1 |
① |
在FeCl2溶液中滴入适量 氯水 |
溶液由浅绿色 变为黄色 |
② |
③ |
| 实验2 |
④ |
在FeCl2溶液中加入锌片 |
 |
⑤ |
Zn +Fe2+= Zn2++Fe |
| 实验3 |
⑥ |
在FeCl3溶液中加入足量 铁粉 |
⑦ |
FeCl3(Fe3+)具有氧化性 |
⑧ |
| 实验4 |
⑨ |
在FeCl3溶液中滴入适量KI溶液和 淀粉溶液 |
淀粉溶液变蓝 |
⑩ |
2Fe3++2I-=2Fe2++I2 |
填空:
① ③ ⑤
⑧ ⑩
综合以上实验,你能得到的结论是: 。
(2)除了以上性质,你认为FeCl2还可能具有的性质是:(用离子方程式表示,任写一个即可) 。
(3)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液。保存亚铁盐溶液时如何防止亚铁盐被氧化 。
(4)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可): 。
(5)某同学向FeCl2中加入NaClO溶液,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是 。
某小组同学采用以下装置验证SO2的性质:(夹持及加热装置略)
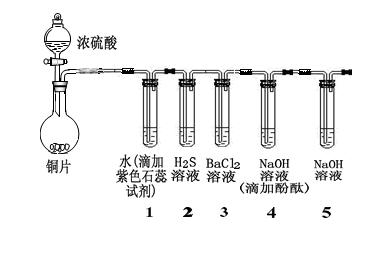
(1)写出圆底烧瓶中发生反应的化学方程式: 。
(2)从实验目的分析,试管1、4的目的都是为了证明SO2具有 (性质),试管2是为了证明SO2具有 (性质)。
(3)除上述两种性质外,你认为SO2还具有的性质是 ,可以通过加入 (填试剂化学式或者名称)加以证明。
(4)经过实验,观察到如下实验现象:
① 试管1中 。
② 试管2中有浅黄色浑浊出现,写出反应的化学方程式 。
(5)试管4中无明显现象,将其分成两份,分别加入下列物质均产生沉淀。将产生的沉淀的化学式填入下表相应位置。
| 加入的物质 |
O2 |
氨水 |
| 沉淀的化学式 |
|
|
(6)试管4和试管5均加入NaOH溶液,在实验目的上的不同点是 。
某学习小组为研究铜与浓、稀HNO3反应的差异,设计了如图所示的实验装置。

实验步骤如下:
Ⅰ.检查装置的气密性;
Ⅱ.向装置A中通入过量的CO2气体,关闭弹簧夹;
Ⅲ.滴加浓硝酸;
……
(1)步骤Ⅲ中滴加浓硝酸的具体操作是 。
(2)A装置中反应的化学方程式是 。
(3)B中溶液慢慢变成蓝色,能解释此现象的化学方程式是 。
(4)证明B中有NO生成的实验操作是 。
(5)步骤Ⅱ向装置A中通入过量CO2气体的目的是 。
(6)上述实验结束后,观察到A装置中的溶液呈绿色,B装置中的溶液呈蓝色。在分析溶液为绿色的原因时,甲同学用加水稀释的方法,乙同学认为不合理,因在稀释时,也会引起Cu2+浓度变化。请设计实验证明绿色是由溶有NO2引起的 。
氯元素是生产生活中常见的非金属元素。某同学探究Cl2及其化合物的性质。
(1)把Cl2通入水中,反应的化学方程式是 。
(2)用氯水进行如下表实验:
| 实验 |
操作 |
现象 |
| Ⅰ |
把氯水点在蓝色石蕊试纸上 |
试纸先变红后褪色 |
| Ⅱ |
向氯水中滴加足量AgNO3溶液,不断振荡 |
ⅰ.有白色沉淀生成 ⅱ.稍后,溶液变为无色 |
① 实验Ⅰ的现象说明,氯水具有的性质是 。
② 实验Ⅱ:a.ⅰ现象的白色沉淀是 。
b.综合ⅰ、ⅱ现象,该同学推测实验Ⅱ发生的反应为:
Cl2 + AgNO3 + =HNO3 +AgCl↓+ (将反应补充完整)
③ 为探究实验Ⅰ中试纸褪色的原因及Ⅱ中另一种反应产物,该同学设计实验如下:
c.将少量稀硝酸点在蓝色石蕊试纸上,试纸变红未褪色;
d.……
上述实验d的方案是 。
(3)该同学查阅资料得知,最初,人们直接用氯气作漂白剂,但使用起来不方便,效果也不理想。经过多年的实验、改进,才有了今天常用的漂白粉。
① 你认为“使用起来不方便,效果也不理想”的原因是 。
② 科研人员以氯气、石灰石、水为原料制取漂白粉,有关反应的化学方程式是: 。
某化学兴趣小组为探究SO2的化学性质,设计了如下图所示的装置进行实验。回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是________,写出圆底烧瓶发生反应的化学方程式________。
(2)E装置中干燥管的作用是____________________________。
(3)实验过程中,观察到B中的现象是_______________,原因是__________________;观察到C瓶中氯水褪色,这是因为SO2具有_______性,反应的离子方程式为__________________。
(4)用装置C还能探究SO2与品红作用的可逆性,请写出实验操作及现象__________________。
(5)充分反应后,小组同学发现铜和硫酸都有剩余,原因是___________________。若想使剩余的铜溶解,可再加入___________(填序号)。
①盐酸;②硝酸;③NaNO3固体;④K2SO4固体
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=________,C=___________,E=___________
| 实验编号 |
温度 |
初始pH |
0.1mol/L草酸溶液体积/mL |
0.01mol/LKMnO4 溶液体积/mL |
蒸馏水体积/mL |
待测数据(混合液褪色时间/s) |
| ① |
常温 |
1 |
20 |
50 |
30 |
t1 |
| ② |
常温 |
A |
B |
C |
30 |
t2 |
| ③ |
常温 |
2 |
40 |
D |
E |
t3 |
(2)该反应的离子方程式_____________________________。
(3)若t1<t2,则根据实验①和②得到的结论是________________________。
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①__________________;②_________________。
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL。滴定到达终点的现象是:__________;实验中所需的定量仪器有__________(填仪器名称)。该KMnO4溶液的物质的量浓度为________mol/L。
为研究浓硫酸的性质,某同学进行如下实验:
(1)称取铁和碳固体混合物12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。取896mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。据此推知气体Y 中SO2的体积分数为 。
(2)分析上述实验中SO2体积分数的结果,该同学认为气体Y中还可能含有H2和CO2
气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
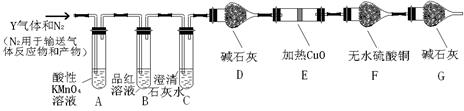
①写出产生CO2的化学方程式 。
②装置A中试剂的作用是 ,装置B的作用是 。
③简述确认气体Y中含有CO2的实验现象 。如果气体Y中含有H2,预计实验现象应是 。
用如下图所示装置证明浓硫酸的强氧化性,并检验产物的性质。请回答:
(1)装置①中反应的化学方程式_______________________。
(2)装置②中的现象是_______________________。
(3)装置③中的现象可证明SO2有______________性。
(4)装置④中反应的离子方程式_________________。
(5)装置⑤的作用是____________________。
有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。
(1)钠与水反应的离子方程式为______________________;
(2)实验中“钠块熔化为闪亮的小球”说明____________________;向烧杯中的溶液中滴加________________,溶液变红,说明钠与水反应生成碱性物质;
(3)如果实验前加入反应管内水的体积为amL,欲使水最终全部被排出,则所取金属钠的质量至少为_______ g(设当时实验条件下气体摩尔体积为VmL/mol)。
某学生对Na2S03与AgN03在不同pH下的反应进行探究
(1)测得Na2S03溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是__________;
(2)调节pH,实验记录如下:
| 实验 |
pH |
现象 |
| a |
10 |
产生白色沉淀,稍后溶解,溶液澄清 |
| b |
6 |
产生白色沉淀,一段时间后,沉淀未溶 |
| c |
2 |
产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
②Ag2O棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为 。
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为 。
该同学设计实验确认了a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀, 置于Na2SO3溶液中,沉淀溶解。另取Ag2SO4固体置于足量 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向x中加人过量浓HNO3,产生红棕色气体。
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀.
①实验I的目的是 。
②根据实验现象,分析X是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,+4价硫的还原性增强,能被+1价银氧化。通过进一步实验确认了这种可能性,实验如下:

①通人Y后,瓶中白色沉淀转化为棕黑色,气体Y是 。
②白色沉淀转化为X的化学方程式是 。
某化学研究性学习小组讨论Fe3+溶液和SO32-溶液之间发生怎样的反应,提出了两种可能,写出预计反应的离子方程式:
一是发生氧化还原反应 ,二是发生彻底互促水解反应 。
为了证明发生怎样的反应,同学们设计并进行如下实验,请填写下列空白:
实验Ⅰ:取5 mL FeCl3浓溶液于试管中,逐滴加入某Na2SO3浓溶液至过量,观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色。这种红褐色液体是 。
向红褐色液体中逐滴加入稀盐酸至过量,可观察到溶液最终变为黄色。将所得溶液加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅱ:将FeCl3和Na2SO3溶液分别稀释后,重复实验Ⅰ,产生的现象完全相同。
同学们由上述实验得出的结论是 。
指导老师看过上述实验步骤后认为该设计有缺陷,应在开始实验前对某主要药品进行检验,该主要药品为 ;检验的目的是 。
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
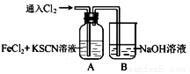
(1)B中反应的离子方程式是 ;
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验。取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 ;
(3)资料显示:SCN -的电子式为 。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 ;
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol;
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
请写出NaCN的电子式___________,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式为 。
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图。

已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大,I2(S) + I- I3-(aq)。
I3-(aq)。
容器中盛放的试剂分别为:
A.MnO2
C.0.5000 mol/L的KI溶液
D.AgNO3溶液
E.NaOH溶液
F.浓盐酸
完成下列填空:
(1)仪器A的名称 ,B中的试剂是_________________。
(2)当D装置中出现 时,停止加热;E的作用是_______________。
(3)当氯气开始进入C时,C中看到的现象是____________________;不断向C中通入氯气,看到溶液颜色逐渐加深,后来出现深褐色沉淀,试运用平衡移动原理分析产生这些现象的原因___________________。
(4)持续不断地向C中通入氯气,看到C中液体逐渐澄清,最终呈无色。推测此时C中无色溶液里含碘物质的化学式_________________(此时溶液中只有一种含碘微粒)。
为确定含碘物质中碘元素的化合价,进行如下实验:
① 取反应后C中溶液5.00mL(均匀)于锥形瓶中,加入KI(过量)和足量稀硫酸。
②向上述锥形瓶中滴加淀粉指示剂,溶液变蓝,用0.6250 mol/L的Na2S2O3溶液滴定至蓝色刚好褪去,耗Na2S2O3溶液24.00 mL。
已知: I2 + 2 S2O32-→ 2 I-+ S4O62-
计算:碘元素的化合价为_______________。
(5)欲检验某溶液中是否含有I-,可使用的试剂为氯水和淀粉溶液。合理的实验操作为_________________________________。
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
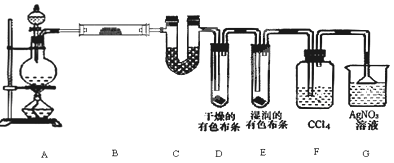
(1)写出装置A发生反应的离子方程式 。
若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
(2)①装置B中盛放的试剂名称为 ,现象是 。
②装置D和E中出现的不同现象说明的问题是 。
③装置F的作用是 。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号),装置中应放入 (填写试剂或用品名称)。
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol·L﹣1、0.001mol·L﹣1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4 mL,H2C2O4溶液(0.1mol·L﹣1 )的用量均为2mL。
(1)该反应的离子方程式: 。
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
催化剂的用量/g |
KMnO4酸性溶液的浓度/mol·L﹣1 |
实验目的 |
| ① |
298 |
0.5 |
0.01 |
(Ⅰ )实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ )实验①和③探究温度对该反应速率的影响; (Ⅲ )实验①和 探究催化剂对该反应速率的影响 |
| ② |
|
|
|
|
| ③ |
|
|
|
|
| ④ |
|
|
|
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是 。若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是 。
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)可以利用酸性高锰酸钾测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数,该小组称量2.68 g草酸钠样品溶于稀硫酸中,然后用0.2000 mol·L﹣1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应 )。
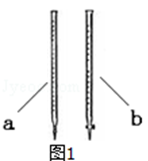
①滴定前是否要滴加指示剂? (填“是”或“否” ),当溶液 ,说明滴定达到终点。
②滴定时用 (填a或b )滴定管盛装KMnO4标准溶液。
③达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
试题篮
()