乙醛能与银氨溶液反应析出银,如果条件控制适当,析出的银会均匀分布在试管上,形成光亮的银镜,这个反应叫银镜反应。银镜的光亮程度与反应条件有关,某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ.探究银镜反应的最佳实验条件的部分实验数据如下表:
| 实验序号 |
银氨溶液 |
乙醛的量/滴 |
水浴温度/℃ |
反应混合液的pH |
出现银镜时间 |
| 1 |
1 |
3 |
65 |
11 |
5 |
| 2 |
1 |
3 |
45 |
11 |
6.5 |
| 3 |
1 |
5 |
65 |
11 |
4 |
| 4 |
1 |
3 |
30 |
11 |
9 |
| 5 |
1 |
3 |
50 |
11 |
6 |
| 6 |
1 |
5 |
80 |
11 |
3 |
请回答下列问题:
(1)若只进行实验1和实验3,其探究目的是____________________。
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11
时,出现银镜的时间范围是____________________。
(3)进一步实验还可探索_______________对出现银镜快慢的影响。
Ⅱ.探究对废液的回收处理:银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环
境,且造成银资源的浪费.通过查找资料,已知从银氨溶液中提取银的一种实验流程如下: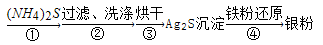
(4)操作④的方法是把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉,反应的化学方程 式为__________________。过滤需要用到的玻璃仪器有_______(填编号)。要得到纯净的Ag2S沉淀,需要洗涤沉淀,实验室过滤器中洗涤沉淀的操作是:________________________。

(5)根据电化原理也可Ag2S转变为Ag,方法是:在铝质容器中加入食盐溶液,再将表面生成Ag2S的银器浸入该溶液中,一段时间后发现黑色会褪去。
①该装置中银器为______极。
②该装置总反应的化学方程式为___________________________。
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:

反应物和产物的相关数据如下:
| |
沸点/℃ |
密度(g.cm-3) |
水中溶解性 |
| 正丁醇 |
117.2 |
0.8109 |
微溶 |
| 正丁醛 |
75.5 |
0.8107 |
微溶 |
实验步骤如下:
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。
②在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。
回答下列问题:
(1)B仪器的名称是 ,D仪器的名称是 。
(2)沸石的作用是 。
(3)将正丁醛粗产品置于分液漏斗中分液时,水在 层(填“上”或“下” )
(4)反应温度应保持在90~95℃,其原因是 。
(5)本实验中,正丁醛的产率为 %。
某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下:


反应物和产物的相关数据列表如下:
| |
沸点/℃ |
密度/(g·cm-3) |
水中溶解性 |
| 正丁醇 |
117.2 |
0.810 9 |
微溶 |
| 正丁醛 |
75.7 |
0.801 7 |
微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是 。
(2)加入沸石的作用是 。
(3)分液漏斗使用前必须进行的操作是 。
(4)反应温度应保持在90~95℃,其原因是 。
(5)本实验中,正丁醛的产率为 。
某兴趣小组采用HgSO4作催化剂,使乙炔水化为乙醛(在75℃左右)。但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现选用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:
(1)实验开始时,仪器A中盛放电石,B中应装入________,其作用是___________。
(2)仪器D中盛放水,其作用是_________。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各种试剂的名称__________。
(4)所选用温度计G的量程表示正确的是________。
| A.0~50℃ | B.0~100℃ |
| C.0~200℃ | D.50~100℃ |
(5)检验乙醛已制出的操作、现象是______________。
(2小题每空3分,1、3小题每空2分,共16分)已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛:

肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的

已知:反应⑥为含羟基的物质在浓硫酸催化作用下分子内脱水的反应。反应⑤为碱性条件下醛醛加成反应,请回答
(1)肉桂醛F的结构简式为: 。E中含氧官能团的名称为 。
(2)写出下列转化的化学方程式:
②_____________________。
③ 。
写出有关反应的类型:① ,④ 。
(3)符合下列要求的E物质的同分异构体有 种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。
仔细体会下列有机合成过程中碳骨架的构建及官能团引入和转化,完成下题:
已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛:
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的: .
.
已知:反应⑤为羟醛缩合反应。请回答:
(1)肉桂醛F的结构简式为: 。E中含氧官能团的名称为 。
(2)反应①~⑥中符合绿色化学思想的是 。
(3)写出下列转化的化学方程式:
② ;
⑤ 。
写出有关反应的类型:③ ;⑥ 。
(4)符合下列要求的E物质的同分异构体有 种(苯环上有两个取代基,其中有一个甲基在对位,且属于酯类)。
某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质,首先做了银镜反应。
(1)在甲酸进行银镜反应前,必须在其中加入一定量的 ,因为 。
(2)写出甲酸进行银镜反应的化学方程式 。
(3)某同学很成功的做了银镜反应,他肯定没有进行的操作 (写字母)
| A.用洁净试管 |
| B.在浓度为2%的NH3·H2O中滴入稍过量的浓度为2%的硝酸银 |
| C.用前几天配制好的银氨溶液 |
| D.在银氨溶液里加入稍过量的甲酸 |
E.用小火对试管直接加热
F.反应过程中,振荡试管使之充分反应
然后,同学们对甲酸与甲醇进行了酯化反应的研究:
(4)乙装置中长导管A的作用是 。
(5)写出甲酸和甲醇进行酯化反应的化学方程式 。
(6)选择甲装置还是乙装置好? ,原因是 。
(7)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有 、 两种必备用品。
(8)一同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,请给予合理的解释 。
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:CH3CH2CH2CH2OH CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| |
沸点/℃ |
密度/(g·cm-3) |
水中溶解性 |
| 正丁醇 |
11.72 |
0.8109 |
微溶 |
| 正丁醛 |
75.7 |
0.8017 |
微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中, (填“能”或“不能”)将Na2Cr2O7溶液加到浓硫酸中,说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(3)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,水在 层(填“上”或“下”)
(6)反应温度应保持在90—95 ℃,其原因是 。
(7)本实验中,正丁醛的产率为 %。
(15分)实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应如下:
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)。
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高于250℃
④苯甲醇沸点为205.3℃
实验步骤如下:
①向图l所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。然后用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10 mL 10%碳酸钠溶液洗涤,10 mL水洗涤,然后分液,将水层弃去,所得醚层进行实验步骤③。
③将分出的醚层,倒入干燥的锥形瓶中,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2 所示的蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必须改变加热方式、冷凝方式,继续升高温度并收集205℃~206℃的馏分得产品A。
④将实验步骤②中保留待用的水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需 (仪器名称)。
(2)步骤②中饱和亚硫酸氢钠溶液洗涤是为了除去 ,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生的原因 。
(3)步骤③中无水硫酸镁的作用是 ,锥形瓶上要加塞的原因是 ,产品A为 。
(4)步骤③中蒸馏除去乙醚的过程中采用的加热方式为 ;蒸馏得产品A的加热方式是 。
(5)步骤④中提纯产品B时所用到的实验方法为 。
(共17分)各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板。
请回答下列问题:
(1)G元素在周期表中的位置_________________,C的电子式____________________。
(2)比较Y与Z的原子半径大小______>________(填写元素符号)。
(3)写出E和乙醛反应的化学反应方程式(有机物用结构简式表示) ;反应类型: 。
(4)写出实验室制备G的离子反应方程式 。
(5)气体D与NaOH溶液反应可生成两种盐P和Q,在P中Na的质量分数为43%,其俗名为 。
(6)实验室中检验L溶液中的阳离子常选用 溶液,现象是 。
(7)A中包含X、Y、Z元素,A的化学式为 。
(8)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其1种同素异形体的名称______________、____________。
)甲醛是深受关注的有机化合物。甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠。
完成下列填空:
1.将4.00 甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,用浓度为1.100
的硫酸滴定,至终点时耗用硫酸20.00
。
甲醛水溶液的浓度为。
2.上述滴定中,若滴定管规格为50,甲醛水溶液取样不能超过
。
3.工业甲醛含量测定的另一种方法:在甲醛水溶液中加入过氧化氢,将甲醛氧化为甲酸,然后用已知浓度的氢氧化钠溶液滴定。
+
→
+
+
→
+
已知
能氧化甲酸生成二氧化碳和水。
如果用量不足,会导致甲醛含量的测定结果 (选填"偏高"、"偏低"或"不受影响"),因为;如果
过量,会导致甲醛含量的测定结果 (选填"偏高"、"偏低"或"不受影响"),因为 。
4.甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示如下:
+
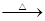
+
↓ +
若向足量新制氢氧化铜中加入少量甲醛,充分反应,甲醛的氧化产物不是甲酸或甲酸盐,设计一个简单实验验证这一判断。
①主要仪器:试管 酒精灯
②可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液
【改编】α,β不饱和化合物在有机合成中有着广泛的用途。反应①是合成α,β不饱和化合物的常见的方法。
反应①: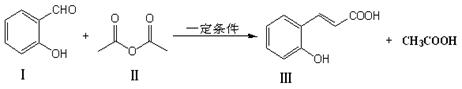
(1)化合物Ⅲ的分子中含氧官能团的名称为 ,1mol化合物Ⅰ完全燃烧消耗 molO2。
(2)下列说法中不正确的是 。
| A.反应①属于取代反应 |
| B.1mol化合物Ⅰ、Ⅲ与氢气完全加成均需要4mol氢气 |
| C.化合物Ⅰ、Ⅲ均能与NaHCO3溶液反应 |
| D.化合物Ⅲ与Br2既能发生取代反应,也能发生加成反应 |
(3)化合物Ⅳ可以通过化合物Ⅲ在一定条件下发生分子内的酯化得到;请写出该反应的化学方程式(注明必要的条件) 。
(4)符合下列条件的化合物Ⅳ的同分异构体有____种;
①遇氯化铁溶液显紫色;②能发生银镜反应;③苯环上只有三个取代基
(5)化合物 是由化合物Ⅴ与化合物Ⅱ发生类似反应①的反应得到的,则化合物Ⅴ的结构简式为 。在工业上化合物Ⅱ可以通过CH3CHO在一定条件下与氧气反应制得,在反应中除了生成化合物Ⅱ以外还有水生成,则该反应的化学反应方程式为 。
是由化合物Ⅴ与化合物Ⅱ发生类似反应①的反应得到的,则化合物Ⅴ的结构简式为 。在工业上化合物Ⅱ可以通过CH3CHO在一定条件下与氧气反应制得,在反应中除了生成化合物Ⅱ以外还有水生成,则该反应的化学反应方程式为 。
(14分,每空2分)乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ.探究银镜反应的最佳实验条件的部分实验数据如下表: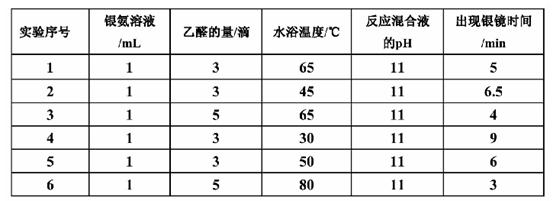
请回答下列问题:
(1)若只进行实验1和实验3,其探究目的是 。
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间范围是 。
(3)进一步实验还可探索 对出现银镜快慢的影响。
Ⅱ.探究对废液的回收处理:银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程如下: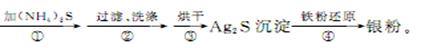
(4)操作④的方法是把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉,反应的化学方程式为 。过滤需要用到的玻璃仪器有 (填编号)。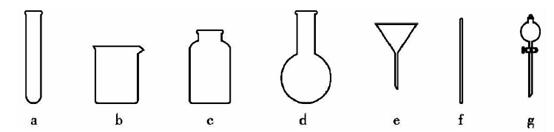
(5)操作④应在 (填实验室设备名称)中进行。
(6)要洗去试管壁上的银镜,采用的试剂是 (填名称)。
(共10分)乙烯是一种用途广泛的基本有机化工原料,可以用来合成碳酸二甲酯(DMC)等重要化工产品(部分反应条件已略去):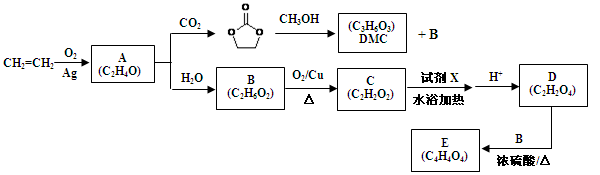
已知:(1)羟基直接与碳碳双键相连不稳定:R—CH=CH—OH→R—CH2—CHO
(2)1mol化合物C与足量银氨溶液反应生成4mol单质银
(1)工业上生产乙烯的主要方法是 ,试剂X为 。
(2)下列说法正确的是 。
A.D→E的反应类型为取代反应
B.化合物A与化合物C含有相同官能团
C.DMC与乙酸乙酯互为同系物
D.DMC酸性条件下水解能产生CO2和甲醇
(3)写出B→C的化学反应方程式 。
(4)现代工业也常用尿素(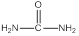 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式 。
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式 。
某学习小组用如下装置(支撑仪器略去)探究乙醇的催化氧化反应和乙醛的性质。
(1)为迅速得到平稳的乙醇气流,可对装置A采用的措施是 。
(2)B中的现象为 。
(3)若装置C中开始发生倒吸,则采取的应急措施是______(填编号)。
a.移去图中的酒精灯 b.将C中的橡皮塞拔出 c.将B尾端的乳胶管取下 d.以上都可以
(4)探究:充分反应后,观察到溴水完全褪色。学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br-)来确定乙醛使溴水褪色的原因。
①假设。请写出假设2的化学方程式。
假设1:CH3CHO+Br2→CH2BrCHO+HBr ;
假设2: ;(加成反应)
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr。
②结论:若实验测得n(Br2)=0.005mol,n(Br-)=0.01 mol,则证明假设 正确。若溴水的体积为10.0 mL(设反应前后体积不变),近似计算反应后C中溶液的pH≈ 。
(5)按下图方案精制含有乙醇和水的乙醛,其中试剂为 ,操作名称为 。
试题篮
()