分子式为C3H8O的液态有机物A 1 mol,与足量的金属钠作用,可以生成11.2 L H2(标准状况),则A分子中必含有一个____________(填官能团的名称)。若该官能团位于碳链的一端,则A的结构简式为____________。A与浓硫酸共热170℃以上,发生分子内脱水的反应,该反应方程式为__________________。A在铜作催化剂时,与氧气共热,可以生成C,写出该氧化反应的化学方程式______________________。
从某些植物树叶提取的挥发油中含有下列主要成分:
(1)写出A的分子式
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)C与氢气完全加成后的产物的结构简式 。
(4)已知:RCH=CHR, RCOOH+R,COOH。写出C在强氧化剂条件下生成的有机化合物的结构简式 。
RCOOH+R,COOH。写出C在强氧化剂条件下生成的有机化合物的结构简式 。
现有:
| A.(CH3)3CCH2OH; | B.(CH3)3COH; | C.(CH3)2CHOH; | D. 四种有机物 四种有机物 |
(1)能氧化成醛的是 ;
(2)能消去成烯的是 ;
(3)D与甲酸发生酯化反应的产物是 。
Ⅰ.化合物甲、乙、丙有如下转化关系:
甲(C4H10O) 乙(C4H8)
乙(C4H8) 丙(C4H8Br2)
丙(C4H8Br2)
回答:
(1)甲中官能团的名称是________,甲可能结构有________种,其中可催化氧化为醛的有________种;使酸性KMnO4溶液褪色的有________种。
(2)甲→乙的反应类型为________,乙→丙的反应类型为________
Ⅱ.(1)乙醇、乙二醇、丙三醇中分别加入足量金属钠,产生等体积的氢气(相同条件下),则上述三种醇的物质的量之比是________。
(2)等质量的①甲醇 ②乙醇③乙二醇④丙三醇,分别和足量的金属钠作用,放出氢气的量由少到多的顺序是__________。(填序号)
(共12分)现有下列种物质:① CH3OH ②
③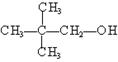 ④
④ ⑤
⑤
(1)能发生消去反应生成烯烃的是 (请填序号,下同),其消去产物依次是 ;由此可以推出苯甲醇(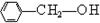 ) (填“能”或“不能”)发生消去反应。
) (填“能”或“不能”)发生消去反应。
(2)能在铜的催化作用下,被空气中氧气氧化成醛的序号分别是 ,请写出能被氧化成酮的反应方程式:
下列3种有机化合物A: CH2=CH-CH3 B: C:CH3CH2OH
C:CH3CH2OH
(1)写出化合物A、C中的官能团的名称 、 。
(2)A在催化剂加热条件下聚合生成聚合物的反应方程式为 ,反应类型为 。
(3) 在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为: 。
在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为: 。
(4)B可以被酸性高锰酸钾氧化成苯甲酸,写出苯甲酸与C物质与浓硫酸共热发生酯化反应的化学方程式: 。
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种转化。
(1)写出A和D的结构简式:A 、D ;
(2)CH2=CH2→A的化学方程式是: ,该反应的
类型是: 反应。
(3)A→C的化学方程式为: ,该反应的
类型是: 反应。
苹果酸是一种常见的有机酸,其结构简式为 :
:
(1)苹果酸分子所含官能团的名称是 、 。
(2)写出苹果酸与足量的钠反应的化学方程式: 。
(3)写出苹果酸在浓硫酸加热下与乙酸反应的化学方程式 _____________________ 、
反应类型为 。
(4) 1mol苹果酸与足量碳酸钠充分反应生成的气体在标准状况下体积最多为 。
酒后驾车已成为一个社会问题。检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种。
(1)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:
3CH3CH2OH+2KMnO4→3CH3CHO+2MnO2+2KOH+2H2O 。
上述反应中发生还原反应的过程是________ →_________。
(2)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,溶液变蓝,乙醇被氧化为乙醛。该反应的化学方程式为_________。
(3)1994年美国首次批准使用唾液酒精含量检测方法,成为血液、呼气之后的第三种检测手段。其原理是在乙醇氧化酶作用下,乙醇与氧气反应生成乙醛和过氧化氢,判断该条件下乙醇、氧气、乙醛和过氧化氢四种物质中氧化性最强的物质是_______(填写化学式)。
I.甲醇是一种可再生燃料,它的沸点为64.7oC。有科学家提出:把含有过量CO2的空气吹入碳酸钾溶液中,然后再把CO2从溶液中提取出来,经化学反应后得到甲醇,其构想流程如下:
试回答下列问题:
(1)写出吸收池中主要反应的化学方程式 。
(2)在2×105pa、300℃合成塔中,若有440gCO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(3)甲醇的一个重要作用是可以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:
。
Ⅱ.二氧化氯(C1O2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备C1O2的反应原理常采用:2NaC1O3+4HC1=2C1O2↑+C12↑+2H2O+2NaC1。若反应中产生0.1mo1C1O2,则转移电子的物质的量为________mol。
(2)目前已开发出用电解法制取C1O2的新工艺。
①下图示意用石墨做电极,在一定条件下 电解饱和食盐水制取C1O2。写出阳极产生C1O2的电极反应式:____。
②电解一段时间.当阴极产生的气体体积为112mL(标准状况)时,停止电解。
通过阳离子交换膜的阳离子的物质的量为 mol;用平衡移动原理解释阴极区pH增大的原因 。
(3)C1O2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-,现用C1O2将CN-氧化,产物中有两种为气体,其离子反应方程式为 。
12.0 g某液态有机化合物A完全燃烧后,生成14.4 g H2O和26.4 gCO2。测得有机化合物A的蒸气对H2的相对密度是30,求:
(1)有机物A的分子式 。
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为 )的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为 (可以不化简)。
)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 molA分子中有x mol氢原子能跟金属钠反应,则x的计算式为 (可以不化简)。
(1)填空:填写合理的物质的结构简式:含氢量最大的有机物是 ;能证明CH4是正四面体结构的有机物是 ;能证明苯分子中不含简单的碳碳单键和碳碳双键的有机物是 ;苯的同系物 : 分子式为C9H12 苯环上一氯代物只有一种的是 ;检验苯和甲苯的物质是 (填写物质名称)。
(2)有机化学已经学了一段时间了。如果你对哪种有机物的结构、性质、用途有独到的见解,请用精炼的积极向上的富有哲理的语言描述.示例:CH3CH2OH:李白斗酒诗百篇.或者酒壮英雄胆,酒是惹祸源。但不要写无酒不成席。
示例:苯:眼中有双键,心中无双键。或者夜阑卧听风吹雨,苯环结构入梦来。
根据乙烯和乙醇的知识填空。
(1)完成下列化学方程式:CH2= CH2+  CH3CH2OH;
CH3CH2OH;
(2)乙醇跟乙酸在浓硫酸催化且加热的条件下反应,制取的是 。
(8分)现有A、B两种链状饱和一元醇的混合物0.1 mol,其质量为4.6g。已知①A和B碳原子数均不大于4,且A<B;②A和B分子中均不含有支链,且都能被催化氧化生成醛。
(1)混合物中A可能的分子式 ;B可能的分子式 。
(2)若n(A):n(B)=1:1时, A的名称 ;B的名称 。
(3)若n(A):n(B)≠1:1时,A的结构简式为 ; B的结构简式为 ; 则 n(A)∶n(B)= 。
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。结合有关知识,回答下列问题:
(1)在试管里加入2mL乙醇。把一端弯成螺旋状的铜丝放在酒精外焰中加热,使铜丝表面生成一薄层黑色的氧化铜,立即把它插入盛有乙醇的试管里(如图),取出铜丝,可以观察到铜丝表面 。
(2)写出乙醇与氧气催化氧化的化学反应方程式 。
(3)乙醇汽油作为一种新型车用燃料,符合我国的能源战略,推广使用乙醇汽油的好处是(写出一条即可) 。
试题篮
()