下表给出了ABCDE五种有机物的有关信息
请根据表中信息回答下列问题:
(1)将A通入到少量的溴的四氯化碳溶液中,主要现象是____________________。
(2)B分子的空间构型为___________________。
(3)实验室用C制取少量的A的反应条件为:以浓硫酸作催化剂、温度为_______℃。
(4)C与E发生反应的化学方程式为_______________________________。
(5)D与新制的氢氧化铜的悬浊液反应的化学方程式为___________________________。
(6)E的一种同分异构体F既能在NaOH溶液中发生水解反应,又能与银氨溶液反应,则F的结构简式为______________________。
苹果酸是一种常见的有机酸,其结构简式为:
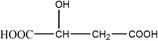
(1)苹果酸含有的官能团名称是__________、__________,在一定条件下,苹果酸可发生化学反应的类型有 (填序号)。
a.水解反应 b.缩聚反应 c.加聚反应 d.中和反应
(2)写出苹果酸与足量金属钠发生反应的化学方程式:__________________________。
(3)1mol苹果酸与足量碳酸钠充分反应生成的气体在标准状况下体积为__________。
(1)乙醇的分子结构如右图: ,其中①②③④⑤表示化学键的代号,用代号回答:
,其中①②③④⑤表示化学键的代号,用代号回答:
i乙醇与钠反应断裂的键是_
ii乙醇与氧气在铜或银作催化剂,加热条件下反应断裂的键是
(2)把一端弯成螺旋状的铜丝放在酒精灯外焰部分加热,看到铜丝表面变成 色。趁热将它反复插入盛乙醇的试管中,铜丝表面又变成 色,并有 气味的物质生成,总反应的化学方程式 。
从A甲醛 B苯 C乙醇 D乙酸 等四种有机物中选择合适的答案,将其标号填在空格内。
(1)能用于除去热水瓶胆水垢〔主要成分:CaCO3 ,Mg(OH)2〕的是 。
(2)家居装修材料中散发出的有毒物质是 和 。
(3)有时医生要在某些发高烧的病人身上涂擦 ,因为该有机物蒸发时,会向人体 (填“吸”或“放”)热。
K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,溶于水,难溶于乙醇,110℃下失去结晶水,230℃分解;是制备负载型活性铁催化剂的主要原料。
实验室利用(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、30%双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:

已知:沉淀: FeC2O4·2H2O既难溶于水又难溶于强酸
6FeC2O4+3H2O2+6K2C2O4 4K3[Fe(C2O4)3]+2Fe(OH)3↓
4K3[Fe(C2O4)3]+2Fe(OH)3↓
2Fe(OH)3+3H2C2O4+3K2C2O4 2K3[Fe(C2O4)3]+6H2O
2K3[Fe(C2O4)3]+6H2O
(1)检验硫酸亚铁铵是否变质的试剂是 ;溶解时加几滴稀硫酸的目的是 。
(2)沉淀过滤后,洗涤1的操作方法是 。
(3)在沉淀中加入饱和K2C2O4溶液,并用40 ℃ 左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌。此过程需保持温度在40 ℃ 左右,可能的原因是 。加入30%过氧化氢溶液完全反应后,煮沸的目的是 。
(4)洗涤2中所用洗涤试剂最合适的是 (填选项字母)。
| A.草酸钠溶液 | B.蒸馏水 | C.乙醇 | D.KCl溶液 |
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径。由二氧化碳制备甲醇过程中可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77KJ/mol
CH3OH(g) △H3=-90.77KJ/mol
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅰ自发进行条件是 (填“较低温”、“较高温”或“任意温度”)。
(2)在一定条件下3L恒容密闭容器中,充入一定量的氢气和二氧化碳仅反应反应Ⅰ,实验测得反应物在不同起始投入量下,
体系中二氧化碳的平衡转化率与温度的关系曲线,如图1所示。
① 氢气和二氧化碳的起始的投入量以A和B两种方式投入
A:n(H2)=3mol n(CO2)=1.5mol
B:n(H2)=3mol n(CO2)=2mol,曲线Ⅰ代表哪种投入方式 (用A、B表示)
②在温度为500K的条件下,按照A方式充入3摩尔氢气和1.5摩尔二氧化碳,该反应10分钟时达到平衡:A.此温度下的平衡常数为 ;500K时,若在此容器中开始充入0.3摩尔氢气和0.9摩尔二氧化碳、0.6摩尔甲醇、x摩尔水蒸气,若使反应在开始时正向进行,则x应满足的条件是 。
b.在此条件下,系统中甲醇的浓度随反应时间的变化趋势如图2所示,当反应时间达到3分钟时,迅速将体系温度升至600K,请在图2中画出3~10分钟内容器中甲醇的浓度变化趋势曲线。

(3)固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图3所示,其中多孔电极均不参与电极反应。图3是甲醇燃料电池的模型。

①写出该燃料电池的负极反应式 。
②如果用该电池作为电解装置,当有16g甲醇发生反应时,则理论上提供的电量最多为 摩尔。
化合物H可用以下路线合成:
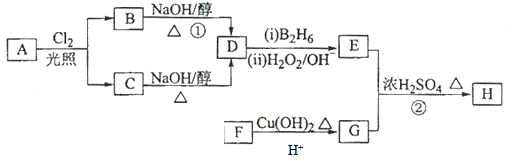
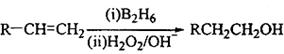
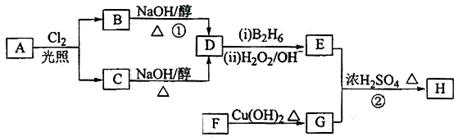 已知:
已知: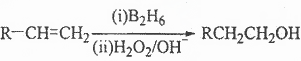
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以生成88gCO2和45gH2O,且A分子结构中有3个甲基,则A的名称(系统命名)为 ;
(2)B和C均为一氯代烃,则反应(1)的反应类型为 ;
(3)在催化剂存在下1molF与2molH2反应,生成3—苯基—1—丙醇。F的结构简式 。
(4)反应②的化学方程式为 ;
(5)与G具有相同官能团的芳香类同分异构体共有 种(不包括G),写出其中任意两种_____________、___________。
填空
(1)某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。A与溴的四氯化碳溶液反应的化学方程式为 。
(2)在一定条件下,由A聚合得到的高分子化合物的结构简式为 。A与氢气完全加成后产物的一氯代物共有 种。
(3)如图所示装置
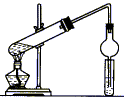
用乙醇、乙酸和浓硫酸制取乙酸乙酯的化学方程式为___________。右侧小试管中所加的试剂为____ ___,装置中干燥管的作用是_______________。
下图中各步反应的最后产物D是一种饱和一元醇,其蒸气的密度是相同状况下H2密度的23倍。试回答: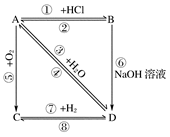
(1)结构简式:A________,D________;
(2)反应类型:⑥________,⑧________;
(3)写出化学反应方程式:④________,⑥________,⑦________,⑧________。
(10分)分子式为C2H6O的化合物A具有如下性质:
A+Na―→慢慢产生气泡
A+CH3COOH 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是( )。
| A.一定含有—OH | B.一定含有—COOH |
| C.A为乙醇 | D.A为乙酸 |
(2)含A的体积分数为75%的水溶液可以用作___________________
(3)A与钠反应的化学方程式:__________________
(4)化合物A和CH3COOH反应生成的有香味的产物的结构简式为________。
(5)A可由含淀粉[(C6H10O5)n]的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出淀粉水解的化学方程式:__________________
已知乳酸的结构简式为  。试回答:
。试回答:
①乳酸分子中含有________和_________两种官能团(写名称);
②乳酸与足量金属钠反应的化学方程式为___________________;
苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果醋是一种常见的有机酸,其结构简式为:

(1)苹果醋中含有的官能团的名称是 ;
(2)苹果醋的分子式为 ;
(3)1 mol苹果醋与足量金属钠反应,能生成标准状况下的氢气 L;
(4)苹果醋可能发生的反应是 。
| A.与NaOH溶液反应 | B.与石蕊溶液作用 |
| C.与乙酸在一定条件下酯化 | D.与乙醇在一定条件下反应 |
(1)为了达到下表中的实验要求,请从“供选择的化学试剂及方法”栏中,选择正确选项的字母代号填入对应的空格中。
| 序号 |
实验要求 |
答案 |
供选择的化学试剂及方法 |
| a |
检验乙酸是否具有酸性 |
|
A.新制的氢氧化铜悬浊液 |
| b |
检验植物油中是否含有碳碳双键 |
|
B.紫色石蕊试液 |
| c |
检验尿液中是否含有葡萄糖 |
|
C.加入饱和Na2CO3溶液,分液 |
| d |
除去乙酸乙酯中的少量乙酸 |
|
D.溴水 |
(2)A的结构简式如下:A分子中两种含氧官能团的名称是 、 。
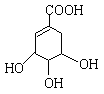
请写出该物质与足量的金属钠发生反应的化学方程式 。
烯丙醇是一种无色有刺激性气味的液体,是重要的有机合成原料,其结构简式为CH2=CH—CH2OH。请回答:
(1)烯丙醇的分子式为 ;烯丙醇中除碳碳双键外还含有官能团的是 。
(2)0.3mol 烯丙醇与足量金属钠反应,能生成标准状况下的氢气 L。
(3)写出烯丙醇与溴水反应的化学方程式 ,
(4)烯丙醇与CH3CO18OH发生酯化反应的化方程式为 ,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为 。
试题篮
()